석고의 화학식은 CaSO4 ∙ 2H2O(황산칼슘 이수화 물)입니다.
석고는 건축 자재로서 다양한 용도로 사용됩니다.
석고는 물과 혼합하여 페이스트를 형성한 다음 굳히는 건조 분말입니다.
건조 후에도 상당히 부드러워 금속 도구로 쉽게 작업할 수 있습니다.
황산칼슘 반수화물(CaSO4 ∙ ½H2O)은 물과 반응하여 황산칼슘 이수화물을 형성하고, 가열하면 황산칼슘 이수화물이 물을 분리하여 황산칼슘 반수화물로 교환합니다.
CaSO4 ∙ 2H2O결정의 분열은 상대적으로 낮은 수소 결합을 가진 CaSO4 이중층(각 층에서 Ca2 +와 SO4 2 이온이 교대로 나란히 있음)에 의해 발생합니다.
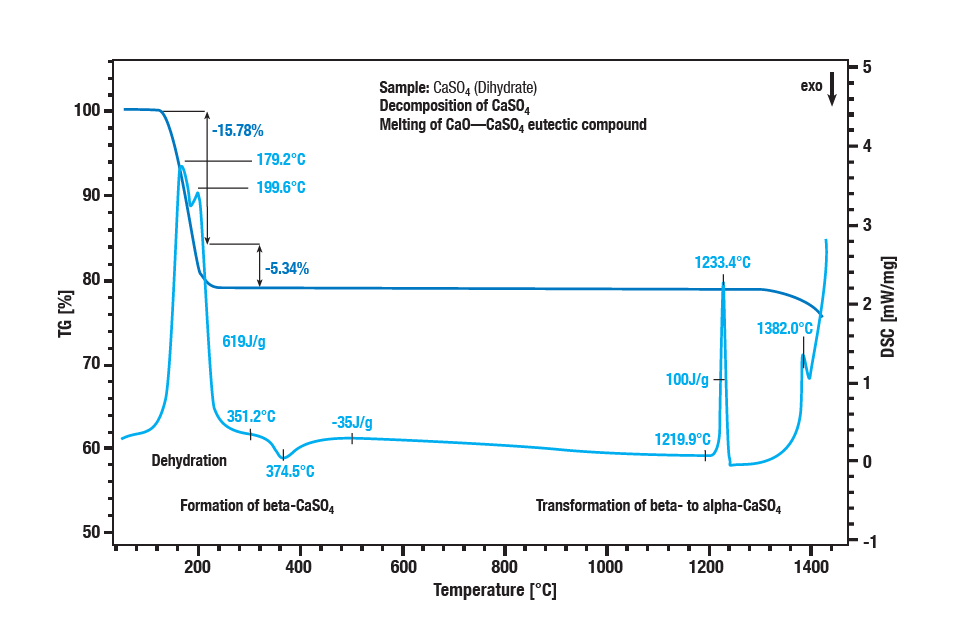
황산칼슘 이수화물의 2단계 탈수는 100°C에서 300°C 사이에서 발생합니다.
첫 번째 단계는 반수화물(CaSO4 ∙ 2H2O에서CaSO4 ∙ ½H2O로)이 형성되는 것입니다.
추가 탈수는 무수물(CaSO4 ½ H2O에서CaSO 4로)을 형성합니다.
약 340°C에서 발열 효과로 인해 무수물은 β-황산칼슘으로 전환됩니다.
약 1220°C에서 곡선의 발열 효과는 β-황산칼슘이 α-황산칼슘으로 전환되는 것입니다.
황산염 분해는 1250°C 이상의 온도에서 질량이 더 손실되는 것이 특징입니다.
황산칼슘은 산화칼슘으로 전환됩니다.
황산칼슘과 산화칼슘의 공융 혼합물의 용융은 1380°C에서 최고조에 달합니다.


