Technologie de l'hydrogène et analyse thermique
Table des matières
Énergie verte – Cycle de l’hydrogène – Économie de l’hydrogène
Une clé essentielle de l’énergie et de la mobilité vertes est l’utilisation de l’hydrogène comme carburant, pour le le stockage de l’énergie et comme outil pour les processus de transfert d’énergie.
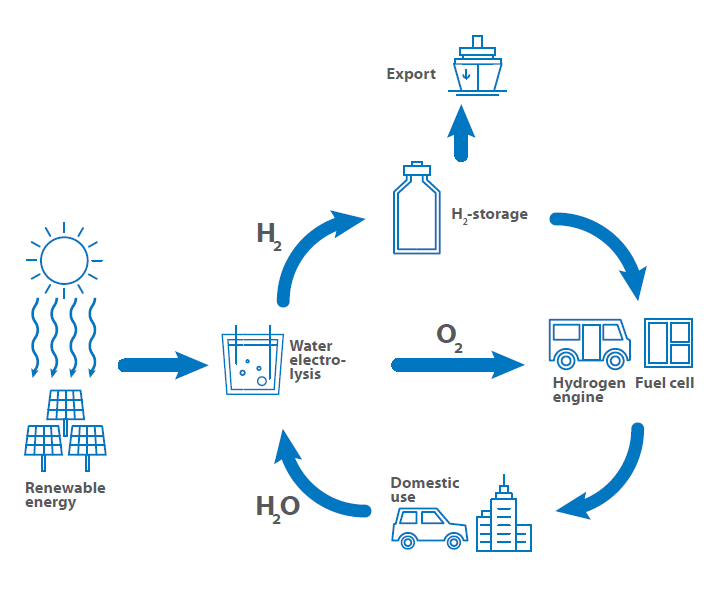
C’est pourquoi le « cycle de l’hydrogène » a été établi, qui montre l’utilisation de l’hydrogène depuis sa production jusqu’à son utilisation comme carburant, en passant par son stockage et son exportation, pour revenir à sa production.
Étant donné qu’il existe de nombreuses voies pour chaque étape de ce cycle, certains concepts de recherche ont été créés pour combler les lacunes et accéder à des techniques nécessaires qui ne sont pas encore au point.
Le site Fraunhofer-Forschungsgesellschaft a élaboré et publié une feuille de route sur l’hydrogène pour l’Allemagne, qui présente tous les domaines et thèmes de recherche.
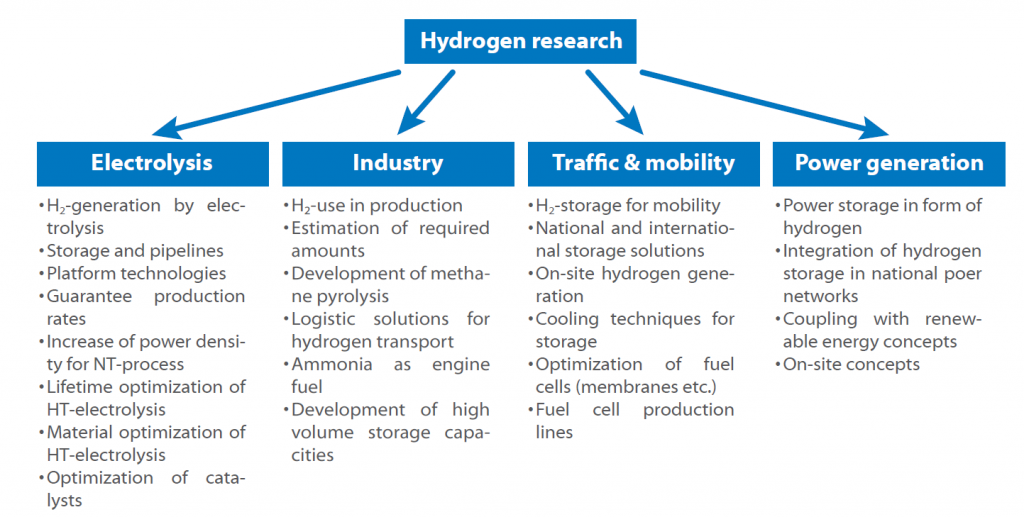
La feuille de route montre l’utilisation possible de l’hydrogène dans un avenir proche.
Le thème clé est toujours le stockage et la production, car chaque secteur est concerné par la question de savoir comment stocker l’hydrogène de manière sûre et efficace.
Une autre question à laquelle il faut répondre est de savoir si une production centralisée ou décentralisée d’hydrogène est plus prometteuse et s’il doit être utilisé comme carburant directement ou sous forme d’ammoniac ou de substances similaires.
1. cycle de l’hydrogène – sources d’énergie renouvelables
Le cycle de l’hydrogène commence par la production d’hydrogène par des centrales électriques vertes.
Les principales sources d’énergie renouvelable comprennent les centrales hydroélectriques, les éoliennes, les panneaux photovoltaïques, les centrales géothermiques et les centrales à biomasse, dans le but de produire de l’énergie en quantité suffisante, sans émissions de CO2 et sans déchets nucléaires.
L’analyse thermique et la science des matériaux sont présentes dans tous les domaines :
- De la recherche sur les matériaux composites, comme ceux utilisés pour les pales d’éoliennes
- à l’optimisation des matériaux semi-conducteurs dans les cellules photovoltaïques
- jusqu’à l’optimisation de la production directe d’hydrogène à partir d’applications de biomasse.

Exemple d’application : Comportement de dilatation thermique des matériaux légers
Un bon exemple de l’utilisation de l’analyse thermique dans le domaine des énergies renouvelables est celui de l’expansion thermique. Comportement de dilatation des matériaux légers tels que les matériaux composites pour les pales d’éoliennes :
Les matériaux composites sont utilisés dans la construction légère ou comme matériaux de construction spéciaux à de nombreuses fins.
Par exemple, les pales des éoliennes sont fabriquées à partir d’alliages d’aluminium légers ou de polymères légers.
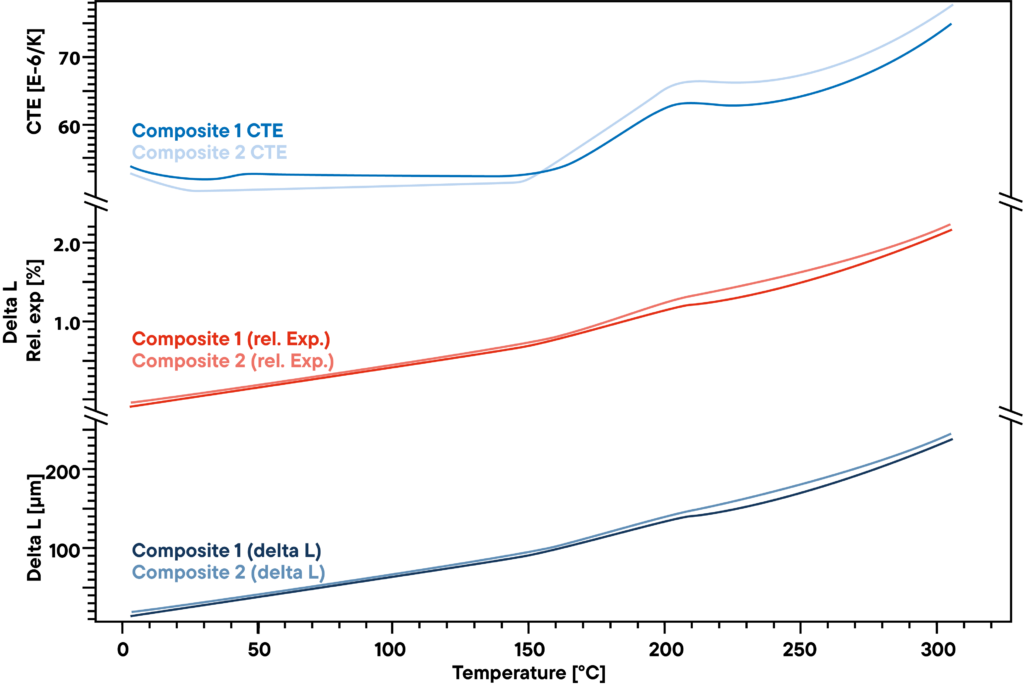
Cette mesure montre la faible différence entre deux matériaux composites polymères utilisés pour des structures rigides mais légères comme les pales d’éoliennes.
Le delta L absolu mesuré à l’aide d’un dilatomètre à tige de poussée Linseis à un chauffage constant à un taux linéaire de 5 K/min (courbe inférieure) ne montre pas de différence grande entre les deux échantillons étudiés.
L’expansion relative (courbes rouges) est également très similaire.
Il y a cependant une légère différence visible lors de l’observation du CTE.
Avant le point de transformation à environ 200°C, il y a un petit effet qui n’est visible que sur l’un des deux échantillons et qui indique une autre petite transformation ou un changement de phase que l’autre matériau ne présente pas.
Exemple d’application : DEA – Analyse diélectrique / Surveillance du durcissement
Pour une production rentable et de qualité des matériaux composites, il est primordial de connaître à la fois le temps et le profil de température exacts nécessaires à l’achèvement de la pièce spécifique.
Si ces paramètres sont mal choisis, soit la qualité ne peut pas être atteinte, soit de l’argent a été gaspillé.
Ce processus de durcissement peut être surveillé par des temps d’attente trop longs au moyen de la DEA – analyse diélectrique.
Le durcissement de la plupart des polymères peut être observé à l’aide de capteurs DEA, qui sont placés dans le matériau non durci.
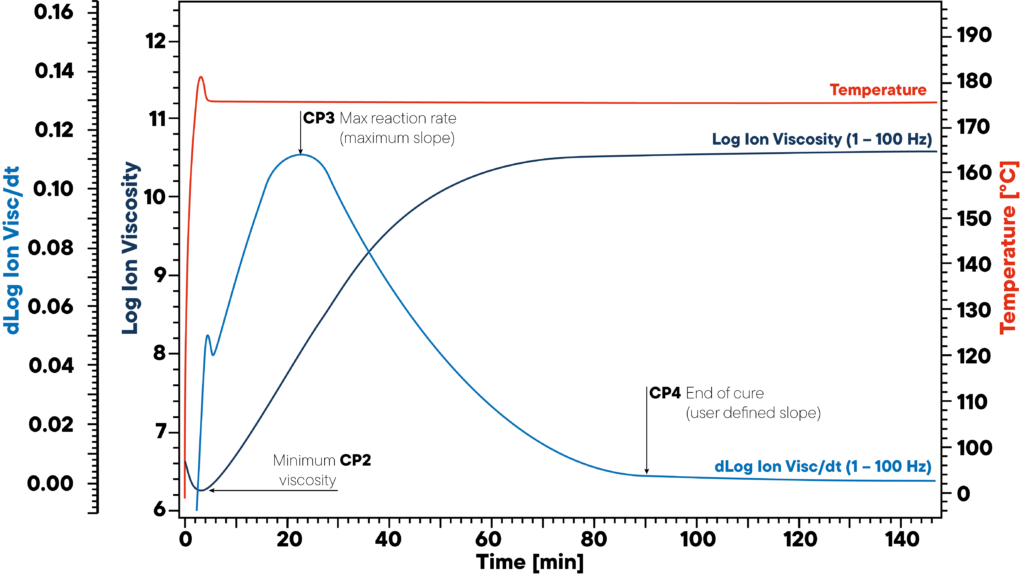
Dans l’exemple, la résine est chauffée de manière isotherme à 180 °C et un capteur DEA est placé.
La courbe rouge indique la température isotherme de l’échantillon et du capteur.
La viscosité ionique et la pente de la viscosité ionique sont surveillées.
Les trois points significatifs CP2, CP3 et CP4 marquent le début (viscosité minimale), la vitesse de réaction maximale (pente maximale) et la fin du durcissement.
Ces informations sont essentielles pour que le polymère durcisse correctement, car les matériaux non durcis peuvent entraîner de graves problèmes de qualité.
Exemple d’application : qualité et comportement des matières premières, par exemple la biomasse
Un autre point important pour la production d’hydrogène est la qualité et le comportement des matières premières, par exemple la biomasse utilisée pour la production d’électricité et d’hydrogène.
 La question est de savoir quelle quantité d’hydrogène peut être obtenue à partir de différentes matières premières lors de la gazéification, quelle quantité d’énergie est nécessaire pour cela et quel est le résultat global. Ceci peut être contrôlé par thermogravimétrie sous pression et par thermogravimétrie et calorimétrie combinées (STA), comme le montre l’exemple d’application suivant.
La question est de savoir quelle quantité d’hydrogène peut être obtenue à partir de différentes matières premières lors de la gazéification, quelle quantité d’énergie est nécessaire pour cela et quel est le résultat global. Ceci peut être contrôlé par thermogravimétrie sous pression et par thermogravimétrie et calorimétrie combinées (STA), comme le montre l’exemple d’application suivant.
Une application typique des mesures de TGA haute pression est l’étude de ce que l’on appelle la gazéification du charbon ou hydrogazéification.
Ce processus, qui consiste à chauffer le carbone dans une atmosphère de vapeur d’eau, est utilisé dans les processus catalytiques, par exemple pour éliminer le monoxyde de carbone des gaz d’échappement et plus particulièrement pour extraire des composés organiques précieux de ressources telles que le charbon de bois ou la biomasse.
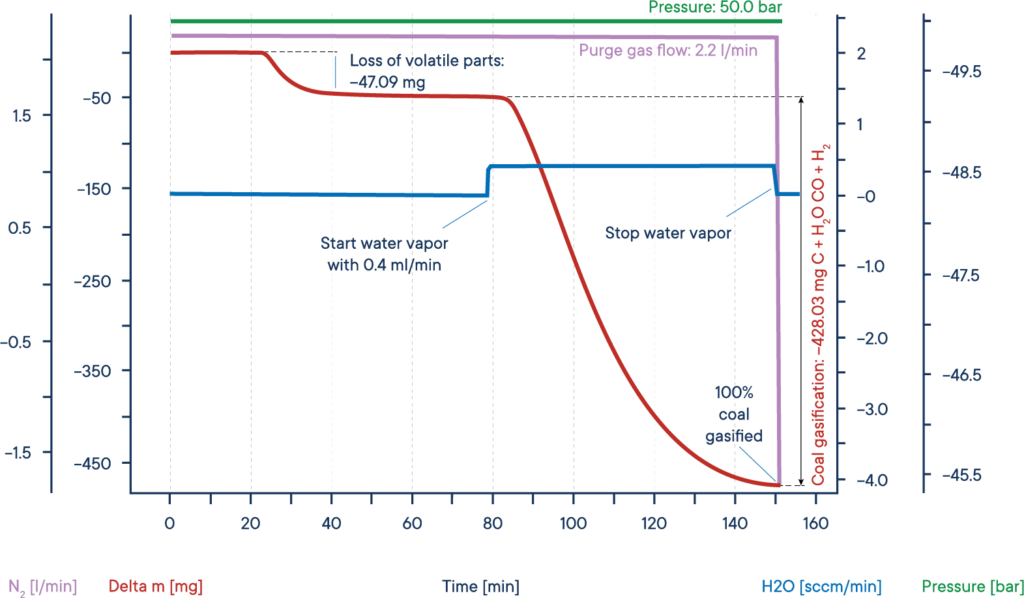
L’exemple donné montre un essai typique de gazéification de la biomasse sèche. L’échantillon de biomasse a été chauffé sous atmosphère d’azote à une pression de 50 bars jusqu’à un plateau isotherme (Haute pression TGA – Thermobalance).
Le signal de masse montre la perte des composants volatils entre 20 et 40 min.
Après l’ajout de vapeur d’eau, la biomasse a été gazéifiée et presque entièrement consommée après 150 min, ce qui a conduit à la formation de H2, CO, CH3OH et d’autres gaz réactifs utiles, comme le montre la courbe de perte de masse rouge.
L’ensemble du processus peut être décrit comme suit : Le carbone réagit avec la vapeur d’eau pour former un mélange de monoxyde de carbone et d’hydrogène.
Le monoxyde de carbone obtenu peut réagir avec une deuxième molécule d’eau pour former du dioxyde de carbone et de l’hydrogène supplémentaire et, finalement, l’hydrogène produit peut former du méthane et d’autres hydrocarbures à partir du monoxyde de carbone.
Exemple d’application : étude du comportement au feu et de la teneur en cendres des matériaux composites
 Enfin, les matériaux composites doivent être recyclés ou valorisés énergétiquement à la fin de la durée de vie du produit.
Enfin, les matériaux composites doivent être recyclés ou valorisés énergétiquement à la fin de la durée de vie du produit.
Pour cela, il peut être intéressant d’étudier le comportement au feu et la teneur en cendres.
Les matériaux carbonés, les matières organiques et les polymères brûlent généralement lorsqu’ils sont chauffés.
L’étude de la décomposition thermique de ces matériaux est donc un peu particulière.
Dans la plupart des cas, elle est réalisée dans des atmosphères inertes plutôt que dans l’air, afin de pouvoir observer les effets de décomposition et de pyrolyse, suivis d’un changement de gaz en oxygène ou en air, ce qui entraîne la combustion du carbone contenu.
Si cette opération est réalisée sur un analyseur thermique combiné (STA), il est possible de mesurer la teneur en carbone, la fraction inorganique et la chaleur dégagée.
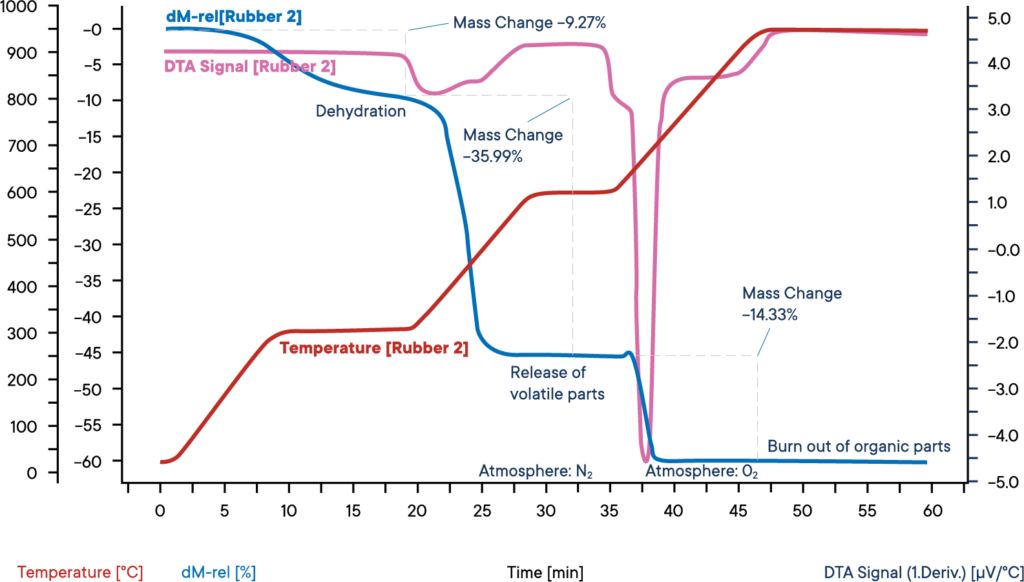
Cette mesure d’un échantillon de caoutchouc industriel a été réalisée à l’aide d’une thermobalance simultanée STA PT 1600, en commençant par une atmosphère d’azote.
L’échantillon a été chauffé en trois étapes, chacune à 30 K/min.
La courbe bleue montre la perte de poids relative.
Dans la première perte de poids, la déshydratation de l’échantillon a lieu.
La teneur en eau était de 9,3 %.
Le signal DTA correspondant (courbe violette) n’a montré aucun effet pendant l’évaporation de l’eau.
Dans la deuxième étape de la réaction, les composants volatils sont libérés par pyrolyse sous atmosphère de N2.
La proportion de ces composants est de 36,0 %.
Leur libération se traduit par un pic de réaction exothermique sur la courbe DTA.
Pour la troisième étape de la réaction, l’atmosphère passe à O2, ce qui entraîne la combustion du carbone résiduel.
La perte de poids est de 14,3 %.
Les 40,4 % restants sont des composants inorganiques tels que des cendres, des scories ou des charges.
2. conversion de l’énergie électrique en énergie chimique (électrolyse, combustibles synthétiques)
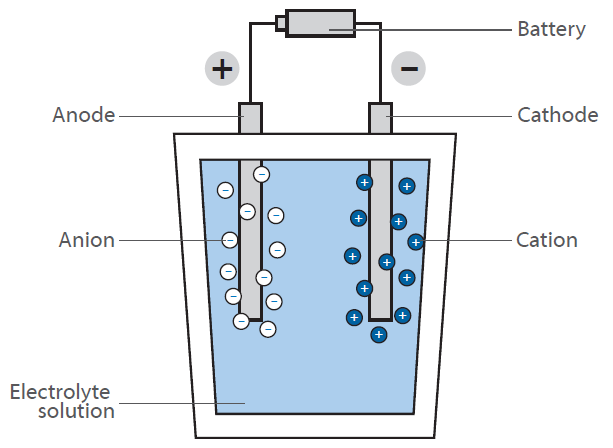
L’électrolyse de l’eau est la décomposition chimique de l’eau en oxygène et en hydrogène par l’application d’une tension externe.
Comme ce processus de production d’hydrogène nécessite beaucoup d’énergie, on utilise également des procédés qui produisent de l’hydrogène à l’aide de catalyseurs ou de chaînes de réaction, comme la gazéification du charbon.
Cependant, l’objectif est d’obtenir une électrolyse directe à haut débit et à haut rendement.
Pour améliorer l’efficacité de l’électrolyse, il faut optimiser les matériaux de la cathode et de l’anode, ainsi que les catalyseurs et les matériaux de surface.
L’énergie électrique étant difficile à stocker, les grandes centrales électriques actuelles, comme les centrales au charbon et les centrales nucléaires, produisent une quantité d’énergie continue pour couvrir la charge de base, et les centrales plus variables, comme les centrales au gaz, sont utilisées pour compenser les fluctuations.
La production d’électricité à partir de sources d’énergie renouvelables étant sujette à des fluctuations (par exemple la nuit, en cas de sécheresse ou d’absence de vent), l’énergie produite doit être stockée afin de répondre aux besoins de la demande d’énergie continue et fluctuante avec la production discontinue des sources d’énergie renouvelables.
De plus, certaines applications, comme par exemple Mobilité (voitures, camions, avions à grande autonomie) nécessitent de grandes quantités d’énergie.
Le stockage de l’énergie électrique dans des accumulateurs n’est pas pratique, car les accumulateurs de la taille requise sont coûteux et ne sont pas opérationnels.
Pour ces applications, il est plus avantageux de convertir l’énergie électrique en énergie chimique sous forme de carburants synthétiques ou d’hydrogène.
Comme les carburants synthétiques sont également produits avec de l’hydrogène, l’étape la plus importante est la production d’hydrogène à partir d’eau par électrolyse.
Exemple d’application : Catalyseurs – Dilatation thermique des fils de platine
 L’analyse thermique peut aider dans ce domaine en caractérisant les matériaux utilisés en termes de stabilité chimique, de conductivité thermique et de capacité de sorption, mais aussi en déterminant la dilatation thermique afin d’améliorer la durée de vie et la qualité.
L’analyse thermique peut aider dans ce domaine en caractérisant les matériaux utilisés en termes de stabilité chimique, de conductivité thermique et de capacité de sorption, mais aussi en déterminant la dilatation thermique afin d’améliorer la durée de vie et la qualité.
Le platine est utilisé comme catalyseur, comme matériau pur ou dans de nombreux alliages.
L’utilisation en tant qu’alliage étant l’utilisation la plus courante en raison des différents avantages que présente un alliage, le comportement physique et chimique change légèrement.
L’exemple montre la différence de dilatation thermique entre le platine et le platine contenant 3 % de rhodium.
Dans l’exemple, le platine et un alliage de platine ont été mesurés dans un dilatomètre à barre de poussée Linseis avec un taux de chauffage linéaire de 5 K/min.
Les deux courbes inférieures montrent la dilatation thermique absolue, tandis que les courbes supérieures montrent la dilatation relative d’un échantillon de platine par rapport à un alliage de platine et de rhodium.
Même si la différence de composition chimique n’est que minime, le comportement de dilatation montre une variation de quelques μm dans la plage de 1000 °C.
Lors de l’utilisation dans une structure complexe telle qu’un réacteur, les valeurs de dilatation exactes doivent être prises en compte afin d’éviter d’endommager l’unité d’électrolyse en raison de coefficients de dilatation différents.

Exemple d’application : Gestion de la chaleur – Conductivité thermique du graphite
Outre la dilatation thermique, qui peut poser problème dans une structure complexe, les propriétés thermophysiques telles que la conductivité thermique et la résistivité sont également très importantes.
 La clé est une bonne gestion de la chaleur. S’il n’y a pas de grandes différences de température à l’intérieur du réacteur, il n’y aura pas de problèmes de dilatation thermique.
La clé est une bonne gestion de la chaleur. S’il n’y a pas de grandes différences de température à l’intérieur du réacteur, il n’y aura pas de problèmes de dilatation thermique.
C’est pourquoi il est bon de connaître également les propriétés de transport thermique de tous les matériaux utilisés.
En résumé : L’optimisation des propriétés thermophysiques permet de réduire les coûts et d’améliorer la qualité.
Les catalyseurs nanostructurés, par exemple, ont une plus grande surface active et nécessitent moins de matière première.
Le graphite est un type de carbone qui se présente sous la forme d’un solide gris foncé.
Il possède une résistance chimique remarquablement élevée et est utilisé dans de nombreuses applications, notamment comme matériau cathodique, matériau de construction, composant de capteur et bien d’autres encore.
Lorsqu’il est chauffé, il réagit avec l’oxygène pour former du monoxyde ou du dioxyde de carbone, mais il peut atteindre des températures très élevées lorsqu’il est chauffé dans un environnement inerte et sans oxygène, c’est pourquoi il est utilisé dans les fours à ultra-haute température comme matériau de four ou même comme élément chauffant.
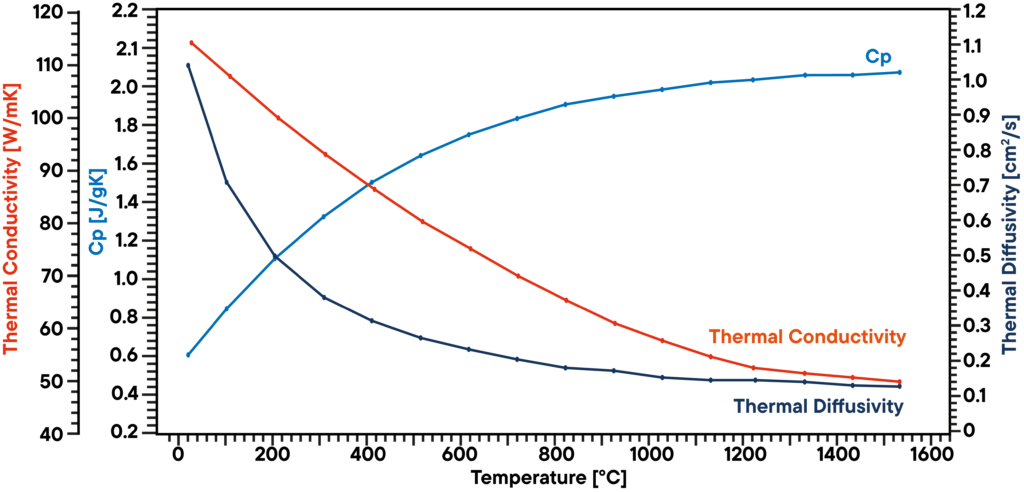
Dans cet exemple, un échantillon de graphite a été analysé sous vide avec un LFA 1000 (Laserflash Analyzer).
La conductivité thermique a été mesurée directement à plusieurs étapes de température entre RT et 1100°C.
La capacité thermique spécifique a été déterminée avec un étalon de graphite connu dans une deuxième position de l’échantillon comme référence dans la même mesure.
Le produit de la conductivité thermique, de la chaleur spécifique et de la densité donne la conductivité thermique correspondante.
Le résultat montre une conductivité thermique linéairement décroissante, ce qui est typique, et une conductivité thermique qui présente un plateau au-dessus de 500°C.
La valeur Cp augmente légèrement avec la température.
Exemple d’application : carburant synthétique – réactions dépendantes de la pression grâce à STA High Pressure
Pour certaines applications, comme les avions, il peut être avantageux de fixer l’énergie électrique sous une forme plus stable que l’hydrogène, ce que sont les carburants synthétiques.
Les carburants synthétiques ont le grand avantage de pouvoir utiliser les infrastructures et les constructions existantes sans les modifier.
L’idée est d’utiliser l’hydrogène vert pour former des hydrocarbures synthétiques.
Lors de la formation, le CO2 de l’atmosphère est capturé, mais lors de l’utilisation (combustion) du carburant synthétique, le CO2 est à nouveau libéré.
Le processus de création de carburants synthétiques (processus Fischer-Tropsch) peut être optimisé avec des systèmes TG et TG/DSC à haute pression comme le LINSEIS High Pressure -STA.
La série Linseis STA HP permet d’effectuer des mesures sous une pression contrôlée et élevée.
Pour certaines réactions telles que la décomposition, l’adsorption et la désorption, le comportement des échantillons et des matériaux dépend fortement des conditions atmosphériques, car il existe une dépendance à la pression pour de nombreuses réactions.
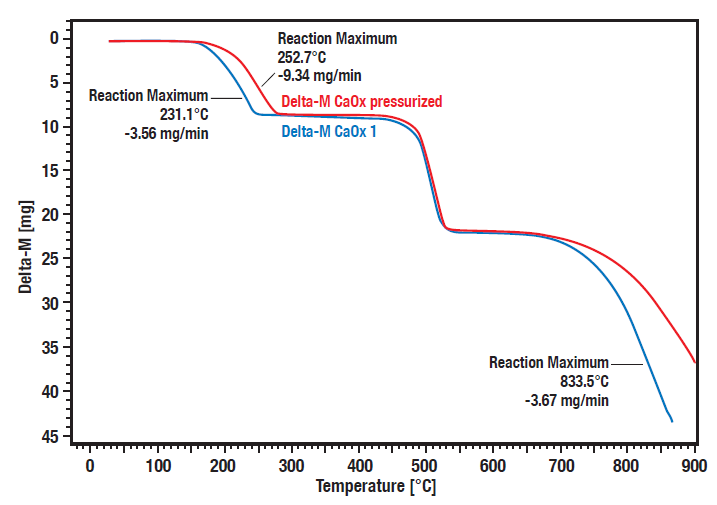
Ces courbes montrent la mesure comparative de la décomposition de l’oxalate de calcium hydraté sous pression (20 bars, courbe rouge) par rapport aux conditions atmosphériques (courbe bleue).
On constate une nette dépendance à la pression des étapes 1 (perte d’eau) et 3 (perte de dioxyde de carbone) de la décomposition.
Les étapes de décomposition 1 et 3 sont décalées vers des températures plus élevées lorsque la pression augmente.
La deuxième étape est la conversion irréversible de l’oxalate organique en carbonate inorganique avec libération de monoxyde de carbone.
Comme ce processus n’est pas réversible, il ne dépend pas de la pression.
3. stockage de l’hydrogène
L’hydrogène étant un gaz très volatile, son stockage et son transport constituent un défi majeur.
Il peut être stocké dans des bouteilles en comprimant le gaz H2, mais d’autres technologies sont préférées en raison de la pression élevée requise (il existe des bouteilles dont la pression maximale peut atteindre 700 bars) et des problèmes technologiques et de sécurité que cela pose (l’hydrogène se diffuse dans le temps à travers tout matériau).
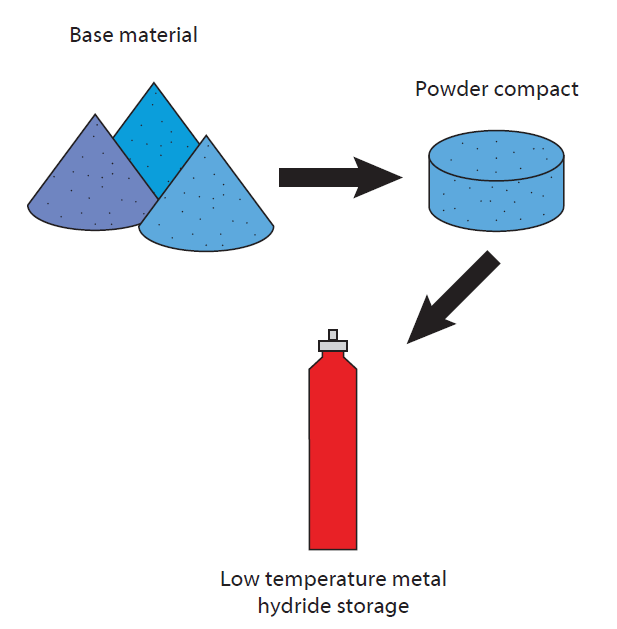
Par exemple, l’hydrogène peut être stocké par sorption sur différents matériaux où il est plus ou moins chimiquement fixé (échafaudages organométalliques (MOF), zéolithes, liquides ioniques, etc.), mais le stockage sous forme d’hydrure métallique est le plus prometteur.
Dans ce cas, l’hydrogène est lié chimiquement à une surface métallique en formant l’hydrure stable.
Ce processus peut être optimisé en augmentant la surface grâce à l’utilisation de matériaux poreux tels que les zéolithes et les échafaudages synthétiques avec des nanopores.
Dans de nombreux matériaux, l’hydrogène peut ensuite être libéré par des changements de température contrôlés ou des changements de pression faciles à appliquer.
Le risque de diffusion incontrôlée n’existe plus.
Exemple d’application : STA-Sorption haute pression
A nalyses thermiques, en particulier les analyses gravimétriquespeuvent aider à déterminer les conditions exactes de sorption, les taux de libération et de stockage afin d’optimiser les cycles de chargement et de libération.
nalyses thermiques, en particulier les analyses gravimétriquespeuvent aider à déterminer les conditions exactes de sorption, les taux de libération et de stockage afin d’optimiser les cycles de chargement et de libération.
La mesure de la sorption, effectuée par des méthodes volumétriques, ne donne généralement pas d’informations sur le flux de chaleur et l’enthalpie.
Si la chaleur de sorption est intéressante, une deuxième expérience est nécessaire.
L’analyseur de sorption gravimétrique (Haute Pression TG-DSC), qui mesure à la fois le changement de poids (thermogravimétrie TGA) et le signal de calorimétrie différentielle à balayage (DSC), offre une alternative beaucoup plus rapide.
La capacité de sorption et la chaleur de sorption peuvent être mesurées au cours d’une même expérience.
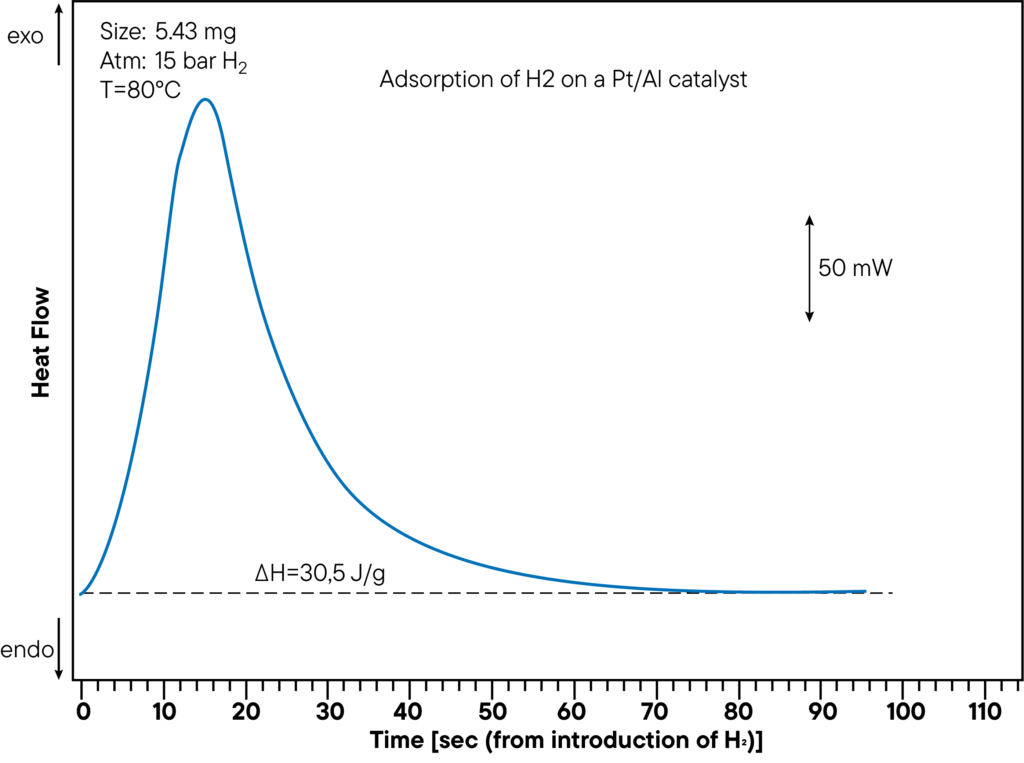
La figure montre la partie DSC de la mesure de l’adsorption d’hydrogène sur un catalyseur Pt/Al à une pression de 15 bar et une température de 80°C.
La chaleur générée est de 30,5 J/g.
La chaleur de sorption a été déterminée directement pendant l’expérience de sorption et montre un pic significatif.
Dans la courbe ci-dessus, le temps entre l’introduction de l’hydrogène et la réaction de sorption a été surveillé afin de montrer à quelle vitesse l’échantillon interagit avec l’atmosphère.
4. les équipements et procédés utilisant l’hydrogène comme combustible
Une fois l’hydrogène produit, stocké et disponible pour une utilisation (mobile), sa haute densité énergétique permet les applications les plus diverses.
Les plus courantes sont l’utilisation comme réducteur, combustible, gaz porteur et pour la synthèse de molécules telles que les hydrates de carbone, l’ammoniac et bien d’autres. Une application courante est le frittage des métaux.
Les pièces métalliques ou contenant des oxydes métalliques sont souvent fabriquées en comprimant des poudres pour obtenir ce que l’on appelle des corps verts. Ces corps verts sont ensuite solidifiés en les chauffant à une température inférieure à leur point de fusion, un processus appelé frittage.
Pendant le frittage, il y a une réduction des dimensions.
Par conséquent, le processus de frittage peut être étudié en mesurant les dimensions. Cela se fait généralement dans un dilatomètre (voir l’exemple d’application).
Pour éviter l’oxydation et également pour réduire la teneur en oxydes dans le produit final, le frittage peut être effectué dans une atmosphère contenant de l’hydrogène ou même dans une atmosphère d’hydrogène pur.
Grâce à ses connaissances dans le domaine de la sécurité de l’hydrogène, LINSEIS est en mesure de fournir des dilatomètres pour une utilisation dans une atmosphère d’hydrogène pur.
Le dilatomètre peut être utilisé pour des mesures de frittage d’hydrogène ou d’expansion dans des atmosphères réductrices.
Le dégazage est couplé à une unité de combustion de sécurité et le système est connecté à un détecteur d’hydrogène qui peut arrêter le système et le purger avec un gaz inerte en cas de dégagement incontrôlé d’hydrogène.
Exemple d’application : Frittage H2 de poudres métalliques
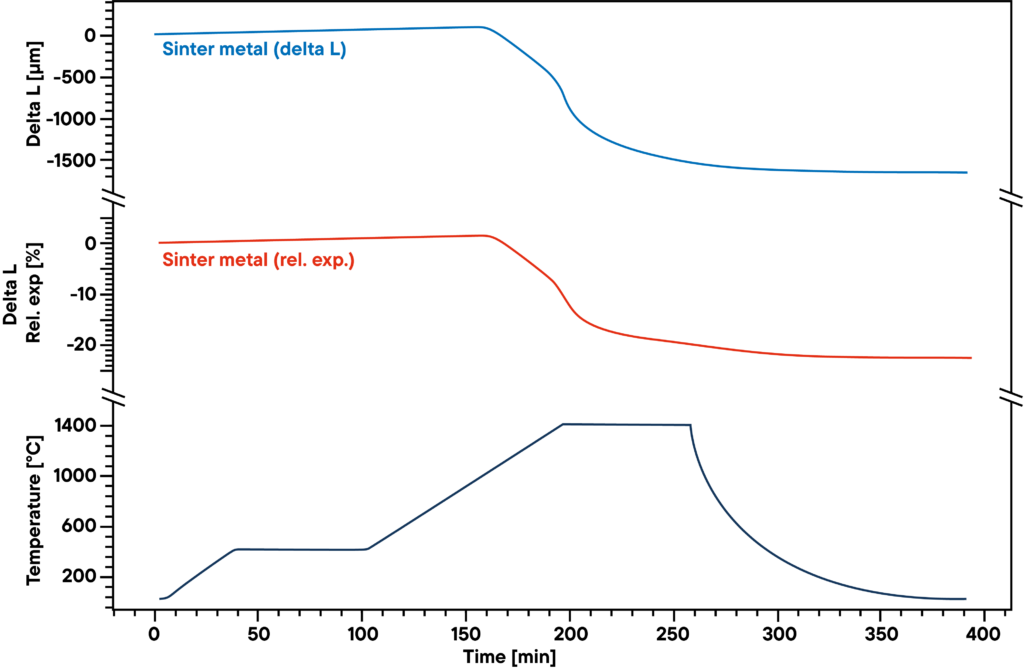
L’exemple montre le frittage sous hydrogène de corps verts en poudre métallique utilisés comme catalyseurs.
La mesure montre la courbe de frittage de la poudre de métal fritté pressée, chauffée en atmosphère absolue d’hydrogène conformément au profil de frittage (courbe inférieure).
L’hydrogène réduit l’oxygène contenu dans l’échantillon pendant le processus de frittage, ce qui entraîne une augmentation de la densité et une diminution de la teneur en oxyde métallique.
Par conséquent, l’atmosphère gazeuse et le profil de frittage ont tous deux une influence importante sur les résultats.
La courbe bleue indique l’expansion et le rétrécissement relatifs, la courbe rouge indique les valeurs absolues.
Le principal frittage s’observe lors de la deuxième phase de chauffage, entre 500°C et 1400°C.
5. technologie des piles à combustible
Cependant, les applications les plus intéressantes et les plus souvent citées pour l’hydrogène sont les piles à combustible, qui peuvent être utilisées dans de nombreuses situations différentes, de l’alimentation des bâtiments en électricité et en chaleur à la propulsion des voitures à autonomie augmentée.
Elles sont l’élément clé de la reconversion de l’énergie stockée de l’hydrogène en électricité.
Dans une pile à combustible, l’hydrogène réagit avec l’air pour former de l’eau.
Cette réaction n’est pas utilisée directement par combustion avec dégagement de chaleur, mais dans une pile à combustible pour produire de l’énergie électrique : le schéma montre une représentation schématique d’une pile à combustible à hydrogène.
Elle a pour fonction de produire de l’énergie électrique « à la demande » par la réaction de l’hydrogène et de l’oxygène.
Contrairement à la réaction directe classique, qui produit de l’eau en libérant une grande quantité d’énergie sous forme de chaleur (imaginez un mélange gazeux d’hydrogène et d’oxygène qui s’enflamme), une pile à combustible possède deux compartiments dans lesquels se trouvent les deux composés.
Au centre de ces chambres se trouve une membrane qui permet la diffusion de l’hydrogène, mais pas des autres molécules.
La réaction entre l’hydrogène et l’oxygène a lieu à la surface de la membrane du côté de la chambre à oxygène, ce qui produit de l’eau qui est évacuée de la cellule.
Cela entraîne une diminution de la concentration d’hydrogène sur la membrane et provoque la migration d’un plus grand nombre de molécules d’hydrogène vers la membrane.
La diffusion d’hydrogène dans le compartiment contenant de l’oxygène génère une tension électrique au niveau de la membrane.
C’est l’énergie qui est maintenant libérée à la place de la chaleur et qui peut être utilisée pour faire fonctionner un moteur.
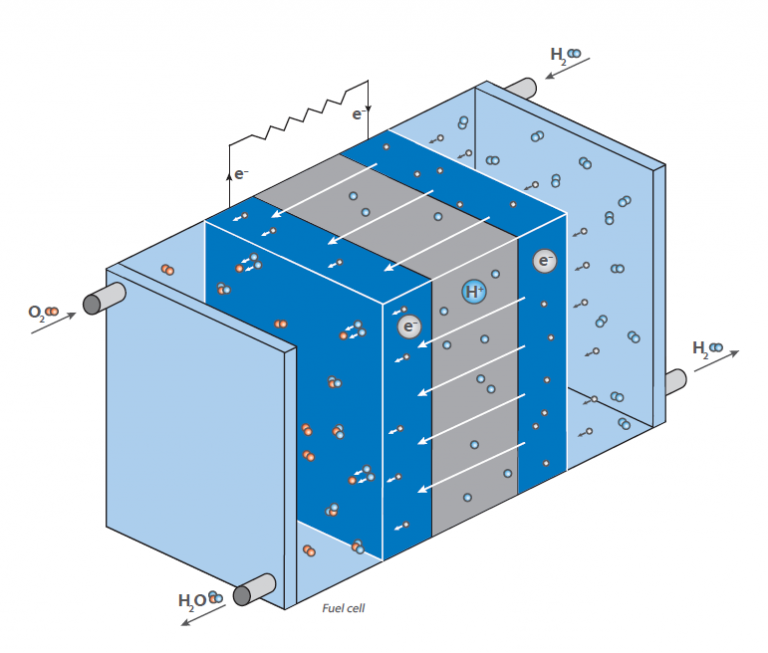
Comme la concentration d’hydrogène peut être contrôlée au niveau du compartiment à hydrogène, il est facile de contrôler le taux de diffusion au niveau de la membrane, comme dans un moteur à essence.
L’hydrogène peut donc être considéré comme un « carburant ».
La membrane est recouverte d’un matériau d’électrode composé de métaux précieux.
Ces métaux servent de catalyseurs et agissent sur les conditions de fonctionnement de la pile à combustible (température, tension, etc.).
Étant donné que les piles à combustible à hydrogène peuvent fonctionner à des températures élevées, jusqu’à 1000°C, et que le métal d’apport utilisé pour leur assemblage doit être thermiquement, chimiquement et mécaniquement stable, l’analyse thermique entre à nouveau en jeu.
Les conditions de fonctionnement des piles à combustible dépendent des matériaux utilisés, qui peuvent agir comme catalyseurs.
Ainsi, toutes les techniques utilisées pour caractériser les catalyseurs trouvent une application dans la technologie des piles à hydrogène/à combustible.
Par conséquent, de nombreuses connaissances en science des matériaux sont nécessaires et de nombreuses techniques d’analyse aident à étudier les matériaux.
Dans ce cas, nous nous concentrerons sur les techniques d’analyse thermique.
Certaines applications de stockage de l’hydrogène fonctionnent à des pressions élevées, dépassant parfois 100 bars, ce qui rend utiles les analyseurs pressurisés.
En outre, toutes les techniques d’analyse nécessitent des précautions en raison de la forte réactivité de l’hydrogène par rapport à l’oxygène/l’air.
Par conséquent, tous les appareils doivent être équipés de fonctions de sécurité afin d’éviter les risques d’explosion.
Exemple d’application : Libération d’hydrogène à partir du stockage de surface
L’exemple d’application suivant montre où l’analyse thermique et les appareils de science des matériaux sont utilisés dans le domaine des piles à combustible.
Le stockage de l’hydrogène peut se faire sous forme d’adsorption de surface, d’adsorption interstitielle ou d’absorption chimique.
Pour la plupart des métaux, l’absorption de surface est la voie la plus prometteuse, car elle est facile à réaliser et la libération d’hydrogène peut être très bien contrôlée.
C’est pourquoi de nombreux métaux à surface spécifique élevée sont étudiés.
L’hydrure de titane est une source d’hydrogène fréquemment utilisée pour la libération contrôlée d’hydrogène dans différentes réactions.
D’une part, il peut être utilisé comme catalyseur dans la chimie des liquides in situ en tant que source d’hydrogène, d’autre part, il peut être utilisé par exemple dans les batteries ou les piles à combustible pour une libération contrôlée d’hydrogène.
Pour avoir une idée de la quantité d’hydrogène libérée à telle ou telle température, il est important de connaître le comportement de décomposition en fonction de la température et la quantité de chaleur libérée, ce qui peut être contrôlé par une analyse thermique simultanée (STA).
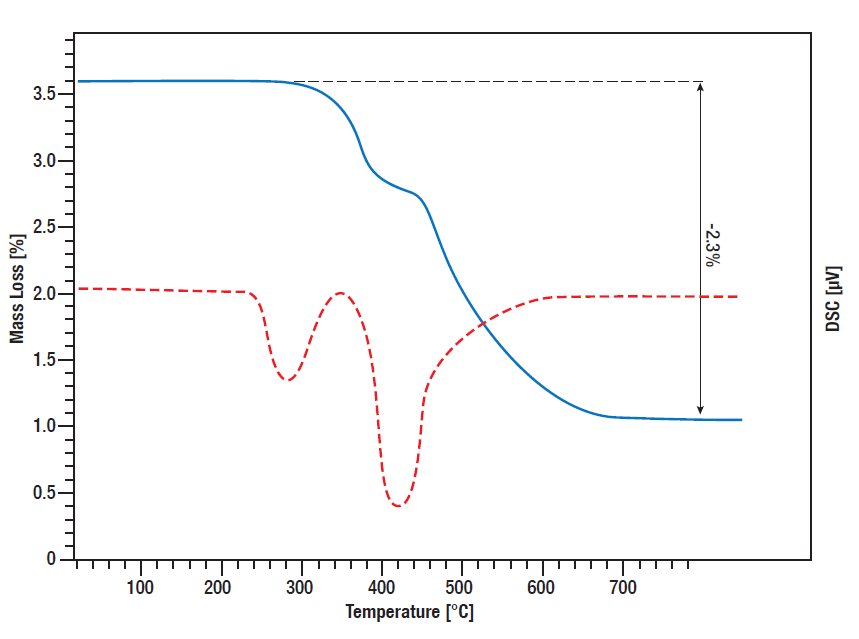
Dans cette mesure STA, la libération d’hydrogène par l’hydrure de titane a été contrôlée.
Les signaux TG et DSC ont été mesurés de la température ambiante à 800°C, tandis que l’échantillon a été chauffé linéairement dans une atmosphère d’argon à 10 K/min.
Entre 300°C et 600°C, il y a une perte de masse en deux étapes de 2,3% au total, ce qui signifie que la quantité totale d’hydrogène lié est libérée dans ce processus.
La courbe DSC montre les pics de désorption correspondants (courbe rouge).
Sécurité des mesures d’hydrogène
L’hydrogène a une forte affinité pour les agents oxydants et les surfaces métalliques, ainsi que pour l’oxygène.
La formation d’eau à partir des éléments (2 – H2 + O 2 = 2 – H2O; ΔH = 286 kJ/mol) est une réaction exothermique, ce qui explique pourquoi l’hydrogène est considéré comme un puissant réservoir d’énergie.
Les mélanges hydrogène-air présentent un risque d’explosion lorsque la teneur en hydrogène est supérieure à environ 4 %.
L’énergie d’activation (sans catalyseur) est élevée, mais en présence d’une flamme, d’une étincelle ou d’une température élevée, ces mélanges peuvent brûler ou exploser.
Par conséquent, toute analyse thermique impliquant des concentrations d’hydrogène supérieures à 4% dans l’air nécessite certaines précautions de sécurité.
Tous les analyseurs thermiques LINSEIS pour applications hydrogène peuvent être équipés des caractéristiques de sécurité suivantes :

- Détecteurs d’hydrogène : ils détectent les fuites éventuelles dans les conduites de gaz.
Ces détecteurs sont positionnés à proximité de l’appareil et détectent toute fuite ou libération accidentelle d’hydrogène. - Rinçage au gaz inerte : Lorsqu’une fuite est détectée et que l’alimentation en hydrogène est arrêtée, l’hydrogène résiduel dans l’analyseur est purgé avec un gaz inerte.
- Soupapes de sécurité:
Dès qu’une fuite d’hydrogène est détectée, des soupapes de sécurité s’activent et interrompent l’alimentation en hydrogène de l’analyseur thermique.
- Unité de déchets pour les dégagements gazeux :
Tous les systèmes à hydrogène Linseis sont équipés d’une unité de torchage au niveau du port de dégagements gazeux.
Les dégagements gazeux (gaz de mesure, gaz de purge et produits de décomposition) passent à travers la flamme qui brûle en permanence afin de garantir qu’aucun gaz inflammable n’est libéré dans l’environnement et ne peut atteindre une concentration critique dans le laboratoire.
L’unité de flamme est chauffée électriquement et dispose d’un mécanisme de sécurité qui empêche le retour de la flamme dans les conduites de gaz.
