Cette étude présente les résultats de mesures TG-DSC sur le nitrate de calcium tétrahydraté – Ca(NO3)2.
4H2O- sont présentés et discutés.
Ce sel est déjà largement utilisé comme matériau de stockage et de transfert de chaleur, car il est peu coûteux et extrêmement efficace.
L’échantillon a été analysé à l’aide d’un instrument Linseis STA PT 1000, qui surveille simultanément le changement de poids et le signal DSC.
L’enthalpie des transitions de phase et la capacité thermique peuvent être déterminées à partir du signal DSC.
L’échantillon a été chauffé dans des creusets en aluminium fermés jusqu’à 180 °C à une vitesse de chauffage de 10 K/min et maintenu isotherme pendant 3 heures.
Il a ensuite été chauffé à 600 °C à une vitesse de chauffage de 10 K/min.
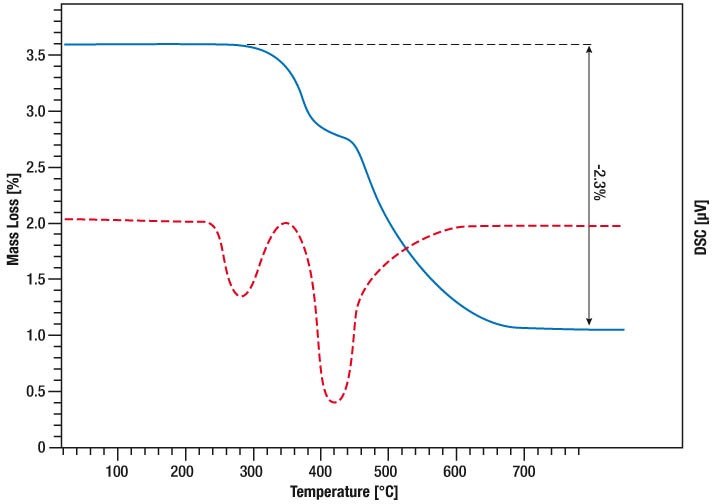
La courbe bleue indique la perte de masse et la courbe rouge le signal DSC.
Le premier pic du signal DSC est dû à la fusion de l’échantillon.
Le début du pic de fusion se situe à 46°C.
Après la fusion complète de l’échantillon, un deuxième pic endothermique apparaît avec un onset à 141 °C.
Le signal TG indique une perte de poids de 32 % dans cette plage de température.
L’eau de cristallisation du nitrate de calcium tétrahydraté se sépare alors et un sel solide anhydre se forme.
Pendant le maintien isotherme à 180 °C, l’échantillon ne subit pas d’autres changements, ce qui signifie que cette température est idéale pour sécher le sel et obtenir le sel anhydre.
Lorsqu’il est à nouveau chauffé à 541 °C, un pic endothermique se produit.
Le sel anhydre fond.
Cependant, le signal TG montre une perte de poids.
Cela indique que le sel se désagrège en fondant.
Par conséquent, l’enthalpie de fusion et la capacité thermique du sel anhydre fondu ne peuvent pas être mesurées directement.
Cependant, cela peut être réalisé en effectuant d’autres mesures TG-DSC de mélanges de sels.
Le nitrate de calcium doit être mélangé avec du nitrate de lithium, de sodium ou de potassium dans différents pourcentages molaires.
Les pics de fusion par DSC des mélanges permettent de déterminer les enthalpies de fusion.
L’enthalpie de fusion du nitrate de calcium pur peut alors être calculée simplement par extrapolation à un pourcentage molaire de 100 % par rapport au nitrate de calcium.
La même méthode est utilisée pour mesurer la capacité thermique du nitrate de calcium anhydre fondu.


