La formule chimique du gypse est CaSO4 ∙ 2H2O(sulfate de calcium dihydraté).
Il existe de nombreuses utilisations du plâtre en tant que matériau de construction.
Le plâtre est une poudre sèche qui est mélangée à de l’eau pour former une pâte qui durcit ensuite.
Il reste assez mou après séchage et peut être facilement travaillé avec des outils métalliques.
Le sulfate de calcium semi-hydraté (CaSO4 ∙ ½H2O) réagit avec l’eau pour former du sulfate de calcium dihydraté et, à l’inverse, le sulfate de calcium dihydraté sépare l’eau sous chauffage et l’échange contre du sulfate de calcium semi-hydraté.
Le caractère clivable du CaSO4 ∙ 2H2O cristallin est causé par des bicouches de CaSO4(dans chaque couche, les ions Ca2 + et SO4 2 sont alternativement côte à côte) avec des liaisons hydrogène relativement faibles.
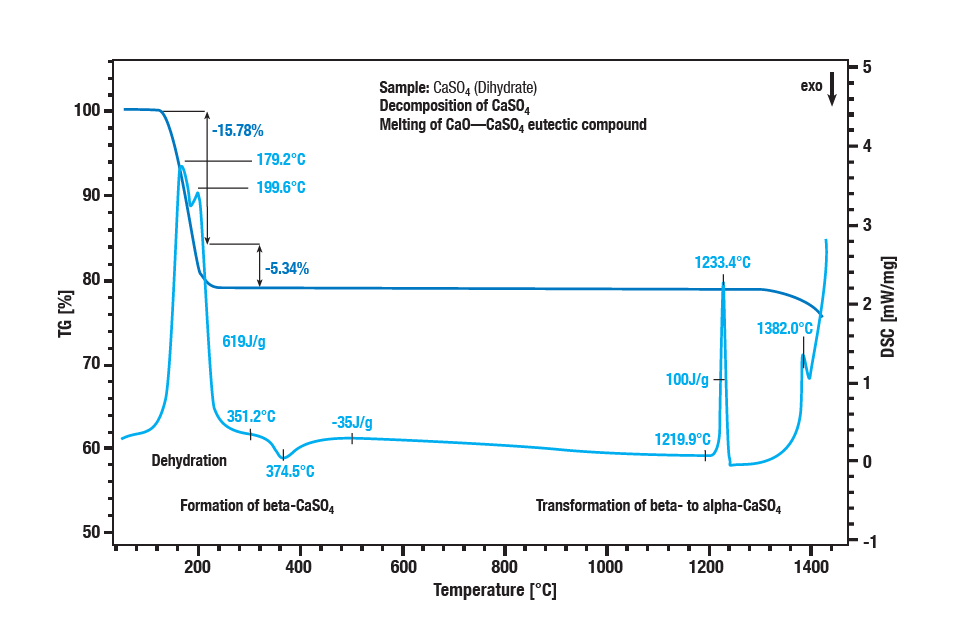
La déshydratation en deux étapes du sulfate de calcium dihydraté se produit entre 100 °C et 300 °C.
La première étape est la formation d’un semi-hydrate (CaSO4 ∙ 2H2O en CaSO4 ∙ ½H2O).
Une autre déshydratation forme l’anhydrate (CaSO4 ½ H2Oen CaSO4).
Avec un effet exothermique à environ 340 °C, l’anhydride se transforme en sulfate de calcium β.
L’effet exothermique dans la courbe à environ 1220 °C est la conversion du sulfate de β-calcium en sulfate de α-calcium.
La décomposition du sulfate se traduit par une nouvelle perte de masse à des températures supérieures à 1250 °C.
Le sulfate de calcium est transformé en oxyde de calcium.
La fusion d’un mélange eutectique de sulfate de calcium et d’oxyde de calcium est le pic à 1380 °C.


