Enthalpie
Enthalpie – une variable mesurée dans l’analyse thermique
Qu’est-ce que l’enthalpie ?
L’enthalpie de réaction est le changement d’enthalpie d’un échantillon au cours d’une réaction chimique.
Les réactions qui libèrent de l’énergie sous forme de chaleur sont dites exothermiques.
Les réactions dans lesquelles de l’énergie doit être fournie sont dites endothermiques.
L’enthalpie de fusion est un exemple simple de processus endothermique, puisqu’il faut généralement faire travailler la chaleur dans un système pour briser sa structure cristalline solide et la convertir en une phase liquide avec des molécules qui se déplacent librement les unes par rapport aux autres.
Un exemple de réaction exothermique est un simple processus de combustion dans lequel une substance réagit avec de l’oxygène pour libérer de l’énergie.
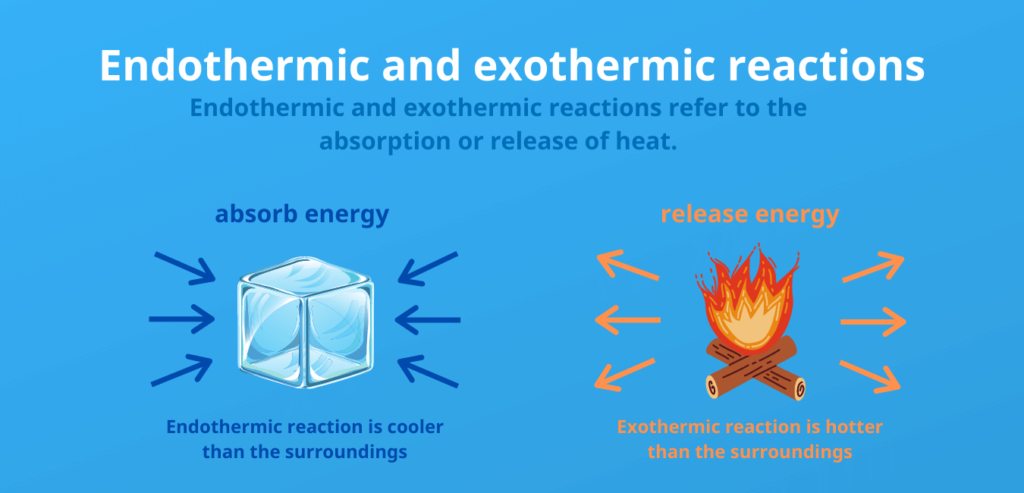
La différence entre un dégagement endothermique et un dégagement exothermique :
Endothermique :
- L’énergie est consommée (la chaleur est absorbée)
- De l’énergie est consommée ou nécessaire pour que la réaction se produise
- Augmentation de l’enthalpie interne
Voici quelques exemples de processus endothermiques :
- Dissolution des sels dans un solvant
- Craquage des alcanes
- Liquides d’évaporation
- Solides en fusion
Exothermique :
- L’énergie est libérée (chaleur)
- La réaction est spontanée ou déclenchée
- Diminution de l’enthalpie interne
Voici quelques exemples de processus exothermiques :
- La réaction thermite
- Une neutralisation (par exemple, le mélange d’un acide et d’une base pour former un sel et de l’eau).
- La plupart des réactions de polymérisation
- Combustion
- Respiration
- Corrosion des métaux (réaction d’oxydation)
- La plupart des processus de cristallisation

