Oxydation
Table des matières
L’oxydation est un processus chimique qui se produit lorsque des électrons sont perdus par une molécule, un atome ou un ion.
Dans le contexte de la calorimétrie, l’oxydation est souvent étudiée comme une analyse thermique, qui implique la combustion ou la dégradation de substances pour libérer de l’énergie sous forme de chaleur.
Calorimétrie différentielle dynamique (DSC) est une technique qui peut être utilisée pour caractériser ce processus, car elle mesure le flux de chaleur associé à l’oxydation d’un échantillon lorsqu’il est chauffé ou refroidi.
Le principe derrière la mesure de l’oxydation par DSC (Differential Scanning Calorimetry) est basé sur la nature exothermique des réactions d’oxydation.
Avec la DSC, l’oxydation peut être étudiée de manière isotherme ou non isotherme.
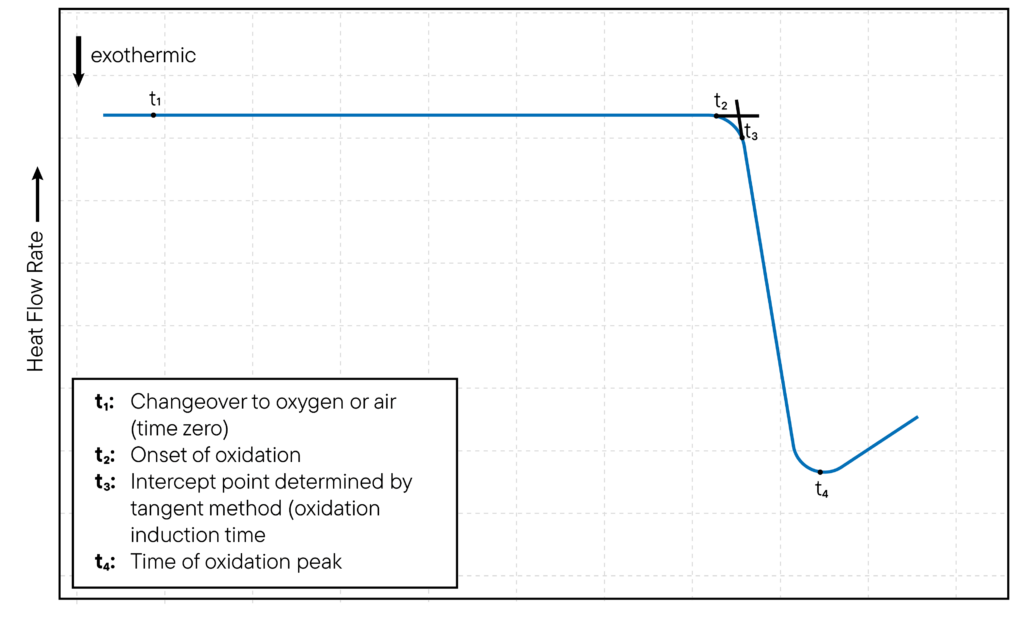
Pour les études d’oxydation isothermes, la température du creuset de l’échantillon DSC est réglée à une température constante et l’oxydation de l’échantillon est surveillée au fil du temps.
Le début de l’oxydation est typiquement indiqué par l’apparition d’un pic exothermique sur la courbe DSC, qui correspond à la libération de chaleur lorsque l’échantillon s’oxyde.
Le moment où le pic exothermique se produit est appelé temps d’induction de l’oxydation (OIT) et constitue une mesure de la résistance de l’échantillon à l’oxydation.
La méthode est illustrée dans la Fig.
1 est représentée.
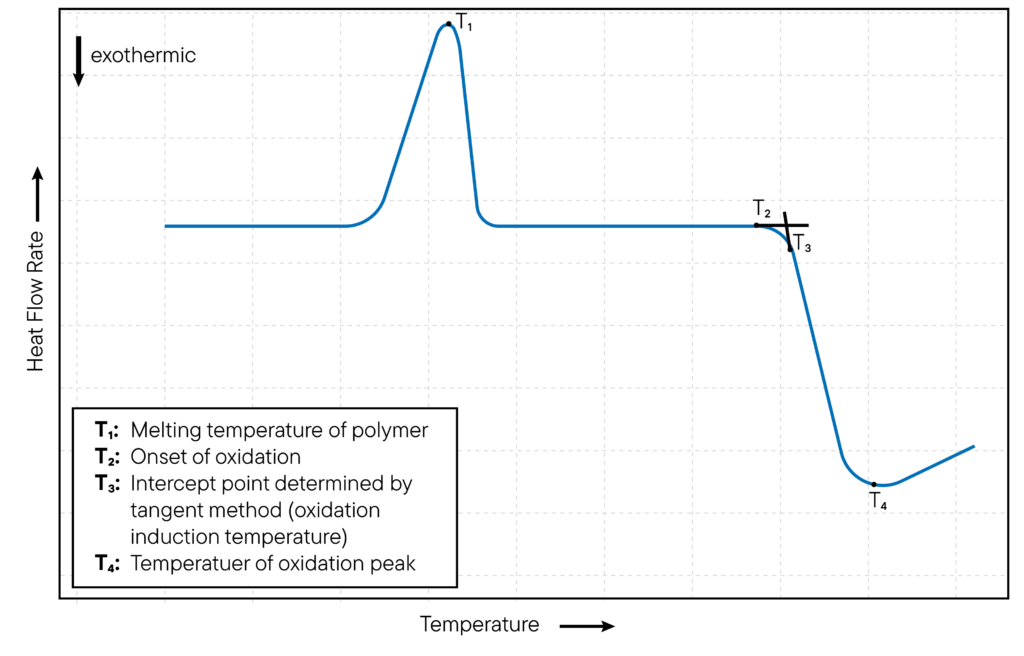
Dans les études d’oxydation non isothermes, la température de la cellule DSC est augmentée à un taux constant et l’oxydation de l’échantillon est surveillée en fonction de la température.
L’appareil DSC détecte un pic exothermique sur la courbe DSC lorsqu’un échantillon s’oxyde et libère de la chaleur.
La température à laquelle le pic se produit est appelée température de début d’oxydation (OOT).
La méthode est illustrée à la fig.
2 est représentée.
L’OOT est une mesure de la stabilité thermique de l’échantillon et est utilisée pour évaluer la stabilité oxydative des matériaux.
En résumé, la mesure du temps d’induction de l’oxydation (OIT) ou de la température de début d’oxydation (OOT) à différentes températures permet de déterminer l’énergie d’activation pour l’oxydation, ce qui donne des informations sur la stabilité thermique de l’échantillon.
La DSC peut également être utilisée pour évaluer les effets des antioxydants et autres additifs sur la stabilité à l’oxydation des échantillons, ce qui est important pour leur qualité et leur durée de conservation.
La DSC peut également être utilisée pour déterminer l’énergie d’activation pour l’oxydation, qui est une mesure de l’énergie nécessaire pour initier le processus d’oxydation.
L’énergie d’activation peut être calculée à l’aide de l’équation d’Arrhenius, qui met en relation la vitesse d’une réaction chimique avec la température à laquelle elle se produit.
L’énergie d’activation pour l’oxydation peut être déterminée en mesurant le temps d’induction de l’oxydation (OIT) ou la température de début d’oxydation (OOT) à différentes températures et en enregistrant les données dans un diagramme d’Arrhenius.
La pente de la ligne résultante est utilisée pour calculer l’énergie d’activation pour l’oxydation.
La courbe DSC peut être analysée afin de déterminer différents paramètres liés à l’oxydation, tels que la température initiale, la température de pointe et la chaleur d’oxydation.
L’OIT et l’OOT sont tous deux des paramètres importants pour l’évaluation de la stabilité à l’oxydation des matériaux, et l’efficacité des antioxydants peut être comparée, en particulier pour les polymères.
Un OIT plus long ou un OOT plus élevé indique une plus grande stabilité oxydative et une plus grande résistance à la dégradation.
Les facteurs pouvant affecter la précision des mesures DSC pour l’oxydation incluent la préparation des échantillons, l’instrumentation et les conditions expérimentales, telles que le taux de chauffage et l’atmosphère.
L’analyse thermique peut être utilisée pour étudier l’oxydation des métaux dans une atmosphère contenant de l’oxygène, dans laquelle un oxyde métallique se forme et dont l’augmentation de masse en fonction de la température ou du temps peut être observée à l’aide de techniques telles que la TGA.
Décomposition pendant l'oxydation
La décomposition est la décomposition d’un composé en molécules ou éléments plus petits [1, section 3.4.4].
Si aucun oxydant, tel que l’oxygène de l’air, n’est présent pendant une mesure, la pyrolyse commence à une température qui dépend de la substance.
Le système de substances est divisé par l’apport de chaleur et se décompose.
Dans une DSC, cela peut être réalisé en utilisant un gaz de mesure inerte tel que l’azote, sinon une oxydation peut se produire et affecter ce processus.
La décomposition est un processus endothermique.
Références :
Stephen M. Hsua et Chun-I Chenb, A chemical kinetics model to predict diesel engine performance.Part II. Procédures d’essai de référence : Tribology Letters, Vol. B. Wunderlich, Thermal Analysis of Polymeric Materials (Analyse thermique des matériaux polymères).
Berlin, Heidelberg : Springer-Verlag Berlin Heidelberg, 2005.G. W. Ehrenstein, G. Riedel et P. Trawiel, Thermal analysis of plastics : Theory and practice.
Munich : Hanser, 2004.- Plastiques – Calorimétrie différentielle à balayage (DSC), ISO 11357-6, 2008.
- Mahbuba Islam, Anna Kaczmarek, and Jolanta Tomaszewska-Gras, Differential scanning calorimetry as a tool to assess the oxidation state of cold-pressed oils during shelf-life : Journal of Food Measurement and Characterization (2023) 17:6639-6651.