Table des matières
Phases de la caractérisation des matériaux
Les matériaux peuvent être classés et décrits de différentes manières. Cela peut se faire, par exemple, sur la base de leur aspect extérieur, de certains paramètres physiques ou même d’impressions plus subjectives, telles que l’odeur ou le goût.
Densité, dureté, capacité thermique ou conductivité
Pour saisir la composition chimique aussi précisément que possible, les propriétés des matériaux qui sont clairement définies et mesurables sont généralement décrites. Des constantes matérielles telles que la densité, la dureté, la capacité thermique ou la conductivité sont souvent utilisées à cette fin. Ces valeurs sont constantes pour la plupart des matériaux tant que la phase à laquelle elles se rapportent est stable.
État de la matière
Une phase est généralement une composition homogène dans le matériau. Le terme phase peut se référer à l’état de la matière (solide, liquide ou gazeux), mais aussi à la structure du réseau cristallin dans une certaine zone du solide ou à des modifications chimiques. Il est important de noter qu’une substance peut exister dans différentes phases en même temps.
Détermination des transitions de phase
Pour savoir dans quelle phase se trouve un matériau et donc quand les paramètres s’appliquent, il est particulièrement important de connaître et de déterminer les transitions de phase d ‘ un matériau . Celles-ci se produisent généralement lorsqu’une certaine température ou un certain niveau d’énergie est atteint ou sous l’influence de la pression ou de réactions chimiques.
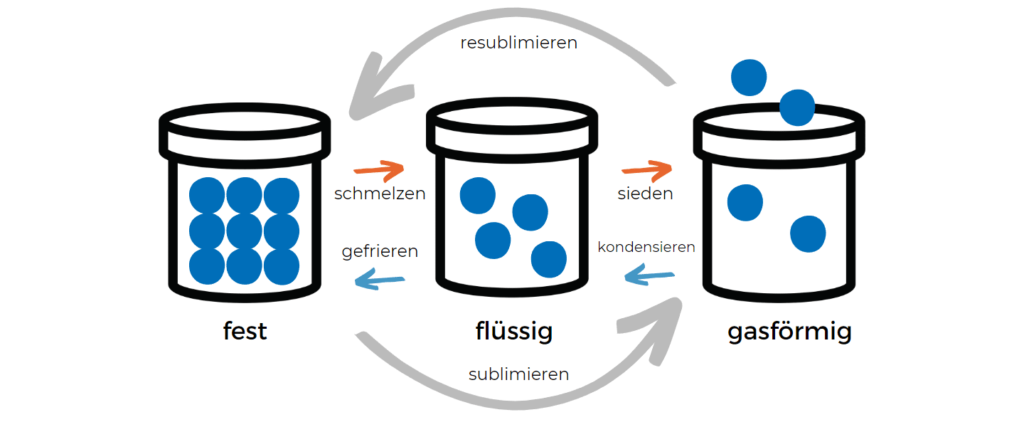
Quelles sont les transitions de phase ?
Comme il existe différentes définitions des phases (état de la matière, structure cristalline, modification, etc.), il existe également différentes transitions de phase.
Dans le cas le plus simple, une transition de phase décrit le changement pur et simple d’un état de la matière, par exemple de solide à liquide.
Les transitions de phase sont généralement classées selon la classification dite classification d’Ehrenfest de Paul Ehrenfest.
Dans ce contexte, les quantités thermodynamiques telles que le volume, enthalpie ou l’entropie sont généralement considérées comme une fonction de la température.
Les transitions de phase sont ensuite divisées en ordres, où l’ordre n de la fonction de la quantité considérée en fonction de la température présente une discontinuité dans la dérivée n. La fonction elle-même et la dérivée n-1 sont continues.
La fonction elle-même et la dérivée n-1e sont continues.
Dans la pratique, on ne distingue que les transitions de phase du premier et du deuxième ordre.
Voici des exemples de transitions de phase du premier ordre :
- Transformations entre les états solide, liquide et gazeux de la matière, en particulier
- Fusion (passage de l’état solide à l’état liquide)
- Évaporation (passage de l’état liquide à l’état gazeux)
- Sublimation (passage de l’état solide à l’état gazeux)
- Solidification ou congélation (passage de l’état liquide à l’état solide)
- Condensation (passage de l’état gazeux à l’état liquide)
- Resublimation (passage de l’état gazeux à l’état solide)
Voici des exemples de transitions de phase du deuxième ordre :
- Changement entre le comportement ferro- et paramagnétique à la température critique ou de Curie
- Passage d’un ordre magnétique à un autre, par exemple d’une structure magnétique commensurable à une structure magnétique incommensurable
- Changement entre le comportement ferro- et diélectrique
- Transition vers la supraconductivité
Généralement, dans une transition de phase du 1er ordre, il y a un saut dans le paramètre d’ordre (par exemple, la densité, l’entropie, l’enthalpie libre). Dans les transitions de phase du second ordre, en revanche, la transition du paramètre d’ordre est continue. Ce n’est que dans la dérivée seconde qu’il y a un changement soudain, par exemple dans la capacité calorifique.
Comment mesurer les transitions de phase ?
Les transitions de phase sont généralement mesurées dans le cadre d’une analyse thermique à l’aide d’un calorimètre différentiel à balayage – DSC).
Si une substance présente une transition de phase au cours d’une mesure par DSC dans la plage de température mesurée, par exemple en raison d’un changement de l’état de la matière ou de la structure cristalline, cette transition peut être bien suivie à l’aide de la DSC.
La plupart des transitions de phase s’accompagnent d’une absorption (endothermique) ou d’une libération (exothermique) d’énergie, qui peut être détectée comme un changement dans le flux de chaleur.
La DSC mesure ces changements de température grâce à un ou plusieurs thermocouples en contact avec le porte-échantillon, comparant ainsi la température exacte de l’échantillon à la température ambiante et à un échantillon de référence.
Le flux thermique exact de l’échantillon à un moment donné peut alors être lu à partir de la différence entre la référence et l’échantillon.
En cas de différence de flux thermique entre l’échantillon et la référence, le signe de la différence indique s’il s’agit d’un processus endothermique ou exothermique.
La position de l’effet qui se produit lorsqu’il est tracé en fonction de la température indique également très précisément le moment où il se produit.
Plus la température exacte de l’échantillon est mesurée avec précision, meilleures sont la résolution et la sensibilité de la DSC.
Pour les transitions de phase, en particulier pour les transitions de phase du second ordre, la vitesse de chauffage est cruciale pour la détection de la transition.
Si la vitesse de chauffage est trop lente, les effets sont souvent à peine détectables, car la différence d’énergie entre l’échantillon et la référence est compensée par le four ou le dispositif de chauffage.
Si le chauffage est trop rapide, l’effet devient plus visible, mais il est également déplacé vers des températures plus élevées.
