Table des matières
Quelle est la différence entre les réactions endothermiques et exothermiques ?
La principale différence entre les réactions exothermiques et endothermiques réside dans l’échange de chaleur avec l’environnement :
- Les réactions endothermiques absorbent l’énergie sous forme de chaleur à partir de leur environnement, ce qui entraîne un refroidissement de l’environnement. Cela signifie que les produits ont plus d’énergie que les réactifs et que la réaction nécessite de la chaleur, ce qui entraîne une variation positive de l’enthalpie (ΔH).
- Les réactions exothermiques libèrent de l’énergie sous forme de chaleur à leur environnement, ce qui conduit à un réchauffement de l’environnement. Dans ce cas, les produits ont moins d’énergie que les réactifs et la réaction libère de la chaleur, ce qui entraîne une variation négative de l’enthalpie (ΔH).
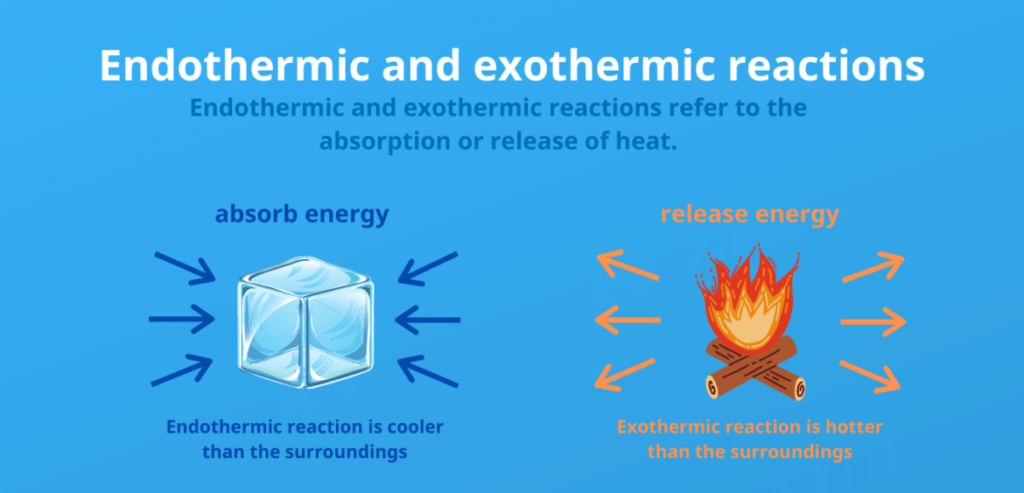
Comment identifier une réaction exothermique ou endothermique ?
Il existe deux méthodes pour reconnaître les réactions exothermiques :
- Changement de température :
- Dans une réaction exothermique, l’énergie est libérée, ce qui entraîne une augmentation de la température du mélange réactionnel. En revanche, dans une réaction endothermique, l’énergie est absorbée, ce qui entraîne une baisse de la température. Vous pouvez observer les changements de température en plaçant un thermomètre dans le mélange réactionnel.
- Changement d’enthalpie :
- La variation de l’enthalpie (ΔH) est la différence entre l’énergie des produits et l’énergie des réactifs. Si ΔH est négatif, cela indique une réaction chimique exothermique, car la quantité d’énergie libérée lors de la formation des produits est supérieure à celle utilisée pour décomposer les réactifs. Si ΔH est positif, cela indique une réaction chimique endothermique, car la quantité d’énergie libérée lors de la formation des produits est inférieure à l’énergie utilisée pour décomposer les réactifs.
Les réactions exothermiques et endothermiques ont des effets différents sur l'environnement :
Les réactions exothermiques libèrent de la chaleur dans l’environnement, ce qui peut avoir des effets positifs et négatifs sur l’environnement. Elles sont impliquées dans des processus tels que la respiration, la combustion et la production d’énergie. Cependant, les réactions exothermiques peuvent également contribuer à des problèmes environnementaux tels que la pollution de l’air et de l’eau.
Autres exemples de réactions exothermiques :
- Combustion de bois ou de charbon :
- La combustion du bois ou du charbon dégage de la chaleur, ce qui en fait une réaction exothermique. Ces réactions sont utilisées dans les chauffages, les fours et les moteurs pour la production d’énergie.
- Oxydation des métaux :
- Lorsque les métaux réagissent avec l’oxygène, comme le fer qui forme de la rouille, il s’agit d’une réaction exothermique qui dégage de la chaleur.
- Explosifs chimiques :
- Les explosions des explosifs chimiques sont des réactions exothermiques qui libèrent de grandes quantités d’énergie sous forme de chaleur et de pression.
Les réactions endothermiques absorbent la chaleur de l’environnement. Bien qu’elles soient essentielles pour des processus tels que la photosynthèse et la cuisson, elles ont généralement un impact direct moindre sur l’environnement que les réactions exothermiques.
Autres exemples de réactions endothermiques :
- Photosynthèse :
- Lors de la photosynthèse, les plantes absorbent le dioxyde de carbone de l’air et le transforment en sucre et en oxygène à l’aide de l’énergie lumineuse. Il s’agit d’une réaction endothermique puisque l’énergie est absorbée sous forme de lumière.
- Eau bouillante :
- Chauffer de l’eau pour la faire bouillir est une réaction endothermique. Pendant le processus d’ébullition, de l’énergie sous forme de chaleur est fournie pour transformer les particules d’eau en vapeur.
- Dissolution du sel dans l’eau :
- Lorsque le sel est dissous dans l’eau, les molécules de sel absorbent la chaleur de l’environnement pour briser les cristaux et se disperser sous forme dissoute.