Oxidación
Índice
La oxidación es un proceso químico que tiene lugar cuando se pierden electrones de una molécula, átomo o ion.
En el contexto de la calorimetría, la oxidación suele estudiarse como el análisis térmico, donde se refiere a la combustión o descomposición de sustancias, para liberar energía en forma de calor.
La calorimetría diferencial de barrido (DSC) es una técnica que puede utilizarse para caracterizar este proceso, ya que mide el flujo de calor asociado a la oxidación de una muestra al calentarla o enfriarla.
El principio que subyace a la medición de la oxidación mediante DSC (Calorimetría Diferencial de Barrido) se basa en la naturaleza exotérmica de las reacciones de oxidación.
En el DSC, la oxidación puede estudiarse de forma isotérmica o no isotérmica.
En los estudios de oxidación isotérmica, la temperatura del crisol del DSC se fija a una temperatura constante y se controla la oxidación de la muestra a lo largo del tiempo.
El inicio de la oxidación suele indicarse por la aparición de un pico exotérmico en la curva DSC, que corresponde a la liberación de calor a medida que la muestra se oxida.
El momento en que aparece el pico exotérmico se conoce como tiempo de inducción a la oxidación (OIT) y es una medida de la resistencia de la muestra a la oxidación.
El método se ilustra en la Fig.
1.
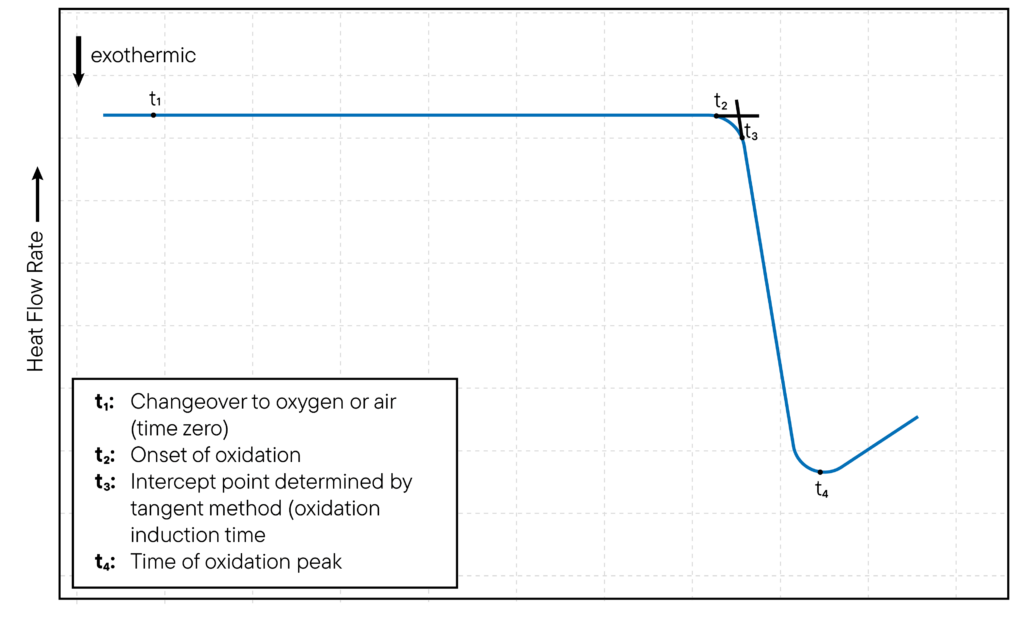
En los estudios de oxidación no isotérmica, la temperatura de la célula DSC se aumenta a un ritmo constante y la oxidación de la muestra se controla en función de la temperatura.
El instrumento DSC detecta un pico exotérmico en la curva DSC, en el inicio cuando una muestra sufre oxidación y libera calor. La temperatura a la que aparece el pico se conoce como temperatura de inicio de la oxidación (OOT).
El método se ilustra en la Fig. 2. El OOT es una medida de la estabilidad térmica de la muestra y se utiliza para evaluar la estabilidad oxidativa de los materiales.
En resumen, midiendo el tiempo de inducción de la oxidación (OIT) o la temperatura de inicio de la oxidación (OOT) a distintas temperaturas, se puede determinar la energía de activación de la oxidación, lo que permite conocer la estabilidad térmica de la muestra.
El DSC también puede utilizarse para evaluar los efectos de los antioxidantes y otros aditivos en la estabilidad oxidativa de la muestra, lo que es importante para su calidad y vida útil.
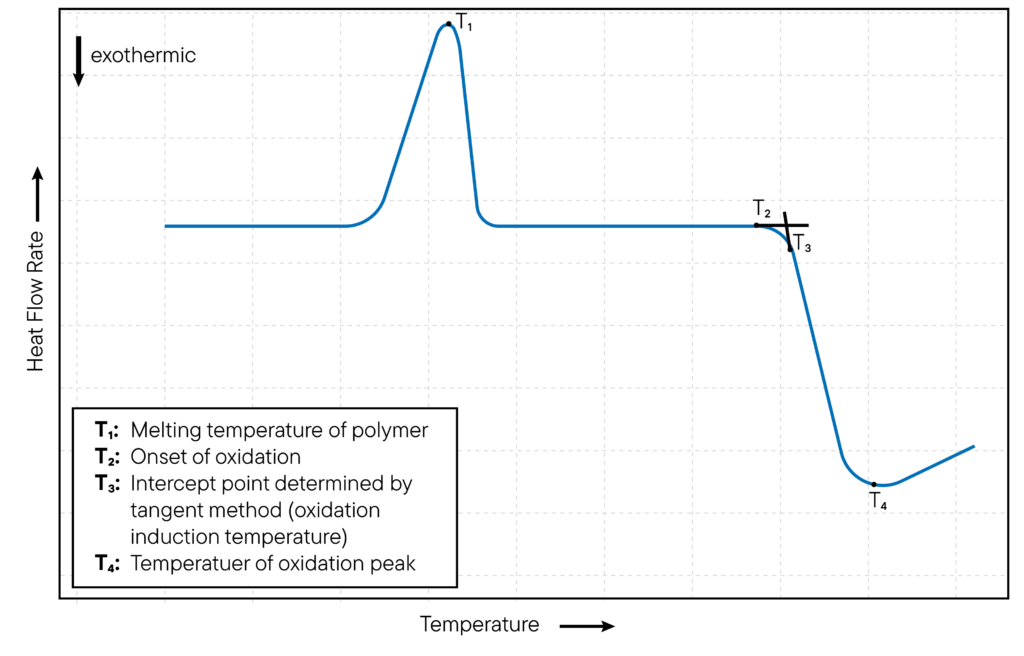
El DSC también puede utilizarse para determinar la energía de activación de la oxidación, que es una medida de la energía necesaria para iniciar el proceso de oxidación.
La energía de activación puede calcularse mediante la ecuación de Arrhenius, que relaciona la velocidad de una reacción química con la temperatura a la que se produce. La energía de activación de la oxidación puede determinarse midiendo el tiempo de inducción de la oxidación (OIT) o la temperatura de inicio de la oxidación (OOT) a diferentes temperaturas y trazando los datos en un gráfico de Arrhenius.
La pendiente de la línea resultante se utiliza para calcular la energía de activación de la oxidación. La curva DSC puede analizarse para determinar varios parámetros relacionados con la oxidación, como la temperatura de inicio, la temperatura pico y el calor de oxidación.
Tanto la OIT como la OOT son parámetros importantes para evaluar la estabilidad oxidativa de los materiales, y la eficacia antioxidante puede compararse especialmente en el caso de los polímeros.
Un OIT más largo o un OOT más alto indican una mayor estabilidad oxidativa y resistencia a la degradación. Los factores que pueden afectar a la precisión de las mediciones DSC de la oxidación incluyen la preparación de la muestra, la instrumentación y las condiciones experimentales, como la velocidad de calentamiento y la atmósfera.
El análisis térmico puede utilizarse para investigar la oxidación de metales en una atmósfera que contenga oxígeno, donde se forma un óxido metálico y puede observarse el aumento de masa dependiente de la temperatura o del tiempo mediante técnicas como el TGA.
Descomposición durante la oxidación
La descomposición se refiere a la ruptura de un compuesto en moléculas o elementos más pequeños [1, apartado 3.4.4]. Si no hay presente ningún oxidante, como el oxígeno atmosférico, durante una medición, la pirólisis se inicia a una temperatura que depende de la sustancia. El sistema de sustancias se divide por la entrada de calor y se descompone. En un DSC, esto puede llevarse a cabo utilizando un gas de muestra inerte, como el nitrógeno, ya que de lo contrario puede producirse oxidación, que afecta a este proceso. La descomposición es un proceso endotérmico.
Cita:
Stephen M. Hsua y Chun-I Chenb, Un modelo de cinética química para predecir el rendimiento de los motores diesel.Parte II.
Procedimientos de ensayo en banco: Tribology Letters, Vol.
14, nº 2, febrero de 2003.- B. Wunderlich, Análisis térmico de materiales poliméricos.
Berlín, Heidelberg: Springer-Verlag Berlin Heidelberg, 2005. G. W. Ehrenstein, G. Riedel und P. Trawiel, Análisis térmico de plásticos: Teoría y práctica.
Múnich: Hanser, 2004.- Plásticos – Calorimetría diferencial de barrido (DSC), ISO 11357-6, 2008.
- Mahbuba Islam, Anna Kaczmarek y Jolanta Tomaszewska-Gras, La calorimetría diferencial de barrido como herramienta para evaluar el estado de oxidación de los aceites prensados en frío durante su vida útil: Journal of Food Measurement and Characterization (2023) 17:6639-6651.