Índice
¿Cuál es la diferencia entre reacciones endotérmicas y exotérmicas?
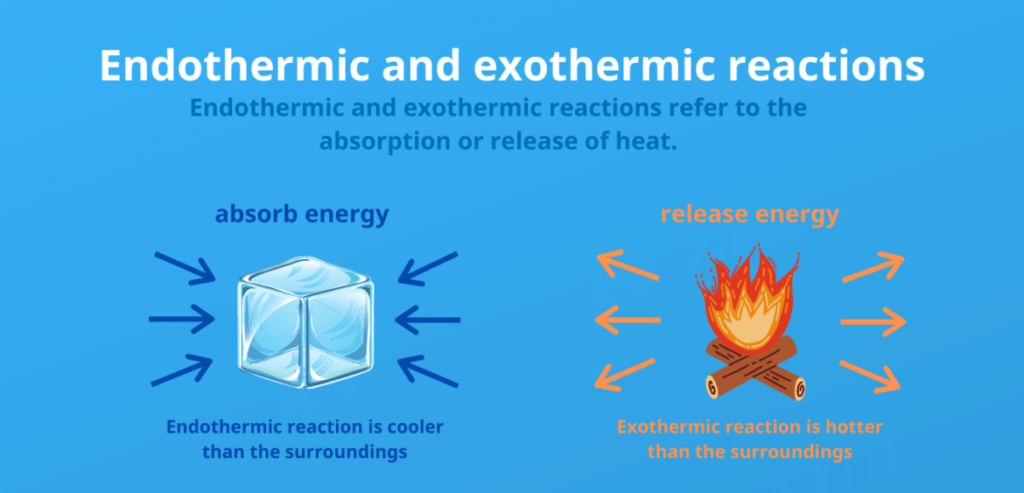
La principal diferencia entre las reacciones exotérmicas y endotérmicas radica en el intercambio de calor con el entorno:
- Las reacciones endotérmicas absorben energía en forma de calor de su entorno, lo que hace que éste se enfríe. Esto significa que los productos tienen más energía que los reactantes, y la reacción requiere calor, lo que conduce a un cambio positivo en la entalpía (ΔH).
- Las reacciones exotérmicas liberan energía en forma de calor a su entorno, lo que hace que éste se caliente. En este caso, los productos tienen menos energía que los reactantes, y la reacción libera calor, lo que provoca un cambio negativo en la entalpía (ΔH).
¿Cómo identificar una reacción exotérmica o endotérmica?
Existen dos métodos para reconocer las reacciones exotérmicas:
- Cambio de temperatura:
- En una reacción exotérmica, se libera energía, lo que provoca un aumento de la temperatura de la mezcla de reacción. Por el contrario, en una reacción endotérmica, se absorbe energía, lo que provoca una disminución de la temperatura. Puedes observar los cambios de temperatura colocando un termómetro en la mezcla de reacción.
- Cambio de entalpía:
- El cambio de entalpía (ΔH) es la diferencia entre la energía de los productos y la energía de los reactantes. Si la ΔH es negativa , indica una reacción química exotérmica, porque se libera más energía cuando se forman los productos que la que se utiliza para descomponer los reactantes. Si el ΔH es positivo , indica una reacción química endotérmica, porque al formarse los productos se libera menos energía que la utilizada para descomponer los reactivos.
Las reacciones exotérmicas y endotérmicas tienen efectos diferentes en el medio ambiente:
Las reacciones exotérmicas liberan calor al medio ambiente, lo que puede tener repercusiones medioambientales tanto positivas como negativas. Intervienen en procesos como la respiración, la combustión y la producción de energía. Sin embargo, las reacciones exotérmicas también pueden contribuir a problemas medioambientales como la contaminación del aire y del agua.
Otros ejemplos de reacciones exotérmicas:
- Combustión de madera o carbón:
- La combustión de madera o carbón libera calor, por lo que es una reacción exotérmica. Estas reacciones se utilizan en calentadores, hornos y motores para producir energía.
- Oxidación de Metales:
- Cuando los metales reaccionan con el oxígeno, como el hierro que forma óxido, se trata de una reacción exotérmica en la que se libera calor.
- Explosivos químicos:
- Las explosiones de los explosivos químicos son reacciones exotérmicas que liberan grandes cantidades de energía en forma de calor y presión.
Las reacciones endotérmicas absorben calor del entorno. Aunque son esenciales para procesos como la fotosíntesis y la cocción, generalmente tienen un impacto directo menor sobre el medio ambiente en comparación con las reacciones exotérmicas.
Otros ejemplos de reacciones endotérmicas:
- La fotosíntesis:
- En la fotosíntesis, las plantas absorben dióxido de carbono del aire y lo convierten mediante energía luminosa en azúcar y oxígeno. Se trata de una reacción endotérmica, ya que se absorbe energía en forma de luz.
- Agua hirviendo:
- Calentar agua para llevarla a ebullición es una reacción endotérmica. Durante el proceso de ebullición, se suministra energía en forma de calor para convertir las partículas de agua en vapor.
- Disolución de la sal en el agua:
- Cuando la sal se disuelve en agua, las moléculas de sal absorben calor del entorno para romper los cristales y dispersarse en forma disuelta.
