Entalpía
Entalpía – una variable medida en el análisis térmico
¿Qué es la entalpía?
La entalpía de reacción es el cambio de entalpía de una muestra durante una reacción química.
Las reacciones que liberan energía en forma de calor se denominan exotérmicas.
Las reacciones en las que hay que aportar energía se denominan endotérmicas.
Las entalpías de fusión son un ejemplo sencillo de procesos endotérmicos, ya que normalmente hay que dar trabajo térmico en un sistema para romper su estructura cristalina sólida y convertirlo en una fase líquida con moléculas que se mueven libremente unas respecto a otras.
Un ejemplo de reacción exotérmica es un simple proceso de combustión en el que una sustancia reacciona con el oxígeno para liberar energía.
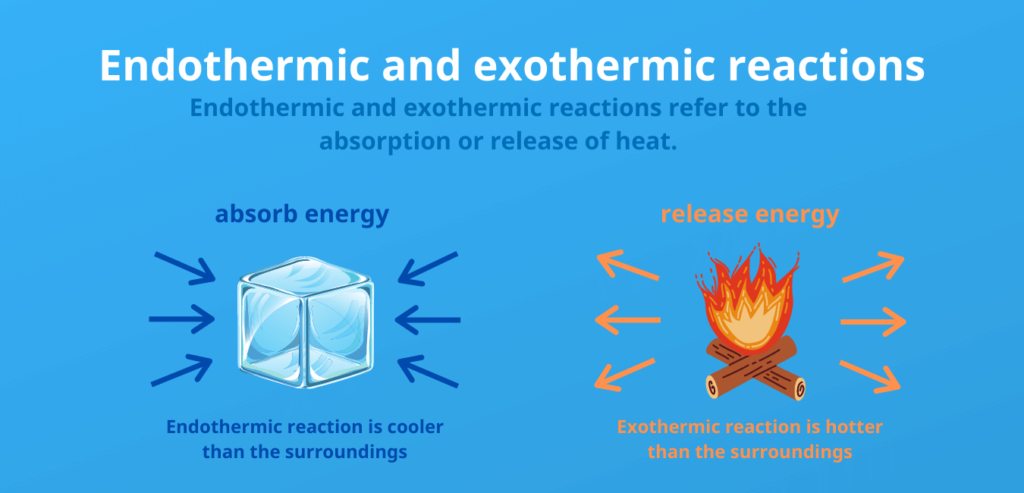
Diferencia entre liberación endotérmica y exotérmica:
Endotérmico:
- Se consume energía (se absorbe calor)
- Se consume o necesita energía para que se produzca la reacción
- Aumento de la entalfa interna
Algunos ejemplos de procesos endotérmicos son
- Disolución de sales en disolvente
- Alcanos craqueantes
- Líquidos evaporantes
- Sólidos en fusión
Exotérmica:
- Se libera energía (se libera calor)
- La reacción se produce de forma espontánea o provocada
- Disminución de la entalfa interna
Algunos ejemplos de procesos exotérmicos son
- La reacción termita
- Una neutralización (por ejemplo, mezclar un ácido y una base para formar una sal y agua)
- La mayoría de las reacciones de polimerización
- Combustión
- Respiración
- Corrosión de los metales (una reacción de oxidación)
- La mayoría de los procesos de cristalización

