Descripción de la
Al grano
Diferencia entre vapor de agua y humedad relativa en el análisis térmico
Cuando el agua se calienta hasta su punto de ebullición o por encima de él, cambia su estado físico de líquido a gaseoso. Se presenta entonces como vapor (de agua). Si este vapor se introduce en una cámara de reacción o en un dispositivo, se habla de aplicación de vapor de agua.
Por el contrario, todo gas puede transportar y contener cierta cantidad de agua a cierta temperatura. Esto se conoce como humedad. Utilizando el aire como ejemplo, se puede determinar que, incluso por debajo del punto de ebullición del agua, el aire siempre contiene una cierta cantidad de agua, lo que se conoce como grado de humedad o humedad relativa se denomina humedad relativa.
A diferencia de la humedad relativa, el agua por encima del punto de ebullición dependiente de la presión, que es de 100°C a nivel del mar, sólo está presente en su fase gaseosa, en forma de vapor de agua. Mezclando el vapor de agua, que se genera en un generador de vapor de agua, con un gas portador como el aire, el nitrógeno o el helio, la concentración (en vol%, wt% o ppm) del vapor de agua en el gas de muestra puede ajustarse de forma variable en nuestros analizadores.
Además, la atmósfera gaseosa del dispositivo puede ser estática o dinámica, según la aplicación. Los ensayos típicos para atmósferas dinámicas de vapor de agua incluyen el calentamiento isotérmico de una muestra y la posterior dosificación de una concentración definida de vapor de agua para iniciar una reacción. Esto puede implicar, por ejemplo, mediciones de adsorción, desorción, reducción, oxidación o conversión.
En el análisis térmico, los generadores de vapor de agua suelen utilizarse en combinación con termobalanzas como TGA y STA (en el rango de alta presión) y dilatómetros se utilizan dilatómetros.
Mediciones dependientes de la presión en una atmósfera de vapor de agua
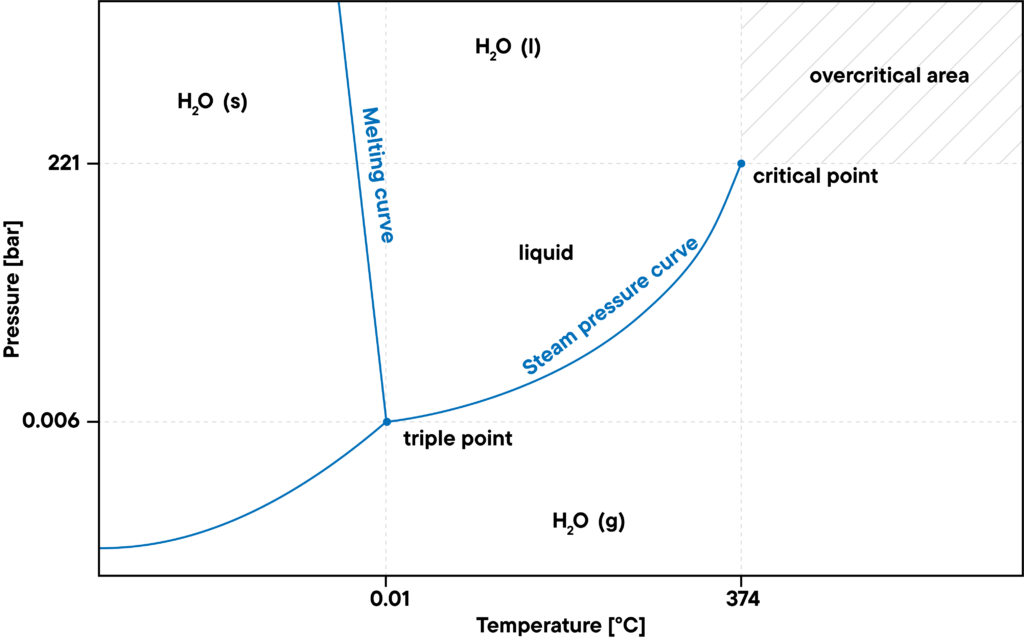
Por otra parte, el nivel máximo de presión del agua gaseosa viene definido por la curva de presión de vapor de saturación. Si la presión es demasiado elevada, el agua se condensa. A temperaturas o presiones más altas, por encima del punto crítico, la densidad del agua líquida es tan alta como la del agua gaseosa, de modo que ya no puede condensarse. Esto se denomina estado supercrítico, por ejemplo, vapor de agua sobrecalentado.
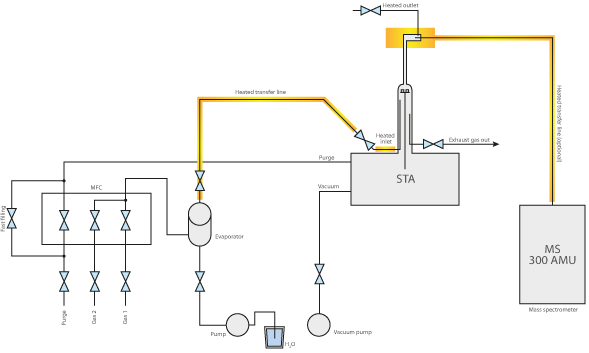
Para crear una atmósfera de H2Oen el horno a temperaturas superiores a 100 °C, debe utilizarse un generador de vapor de agua en combinación con nuestros sistemas. El generador vaporiza agua sin que el vapor de agua residual tenga que mezclarse con otros gases de purga, lo que permite crear una atmósferade H2O al 100% en la muestra. Sin embargo, también se puede diluir añadiendo gases secos mediante MFC. La mezcla se especifica como una concentración variable (en vol%, wt% o ppm) de vapor de agua en un gas portador seco.
¿Tienes preguntas? ¡Llámanos!
+49 (0) 9287/880 0
Nuestro servicio está disponible de lunes a jueves de 8 a 16 h y los viernes de 8 a 12 h.
¡Estamos a tu disposición!
Aplicaciones
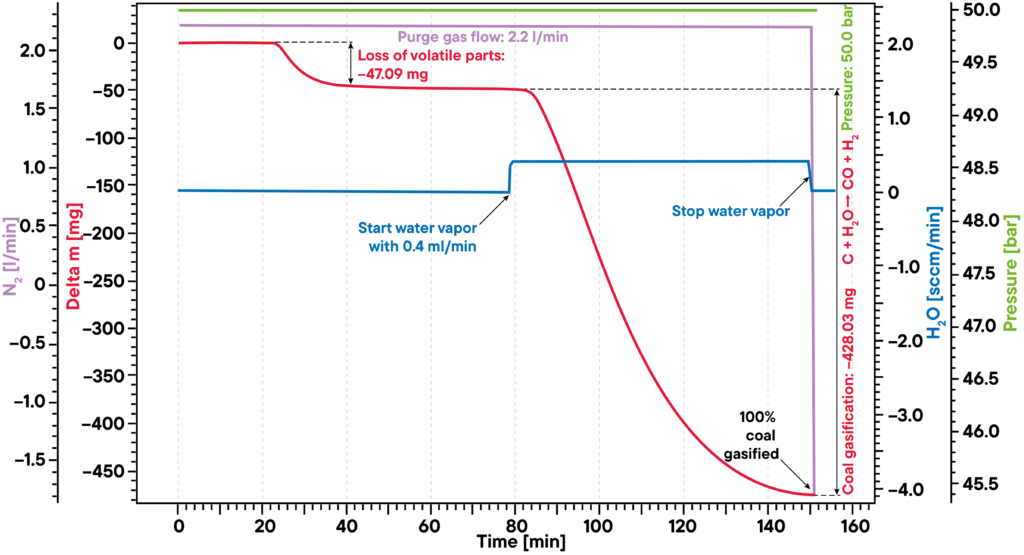
Bien informado


