La fórmula química del yeso es CaSO4 ∙ 2H2O(sulfato cálcico dihidratado).
El yeso tiene diversos usos como material de construcción.
El yeso es un polvo seco que se mezcla con agua para formar una pasta, que luego se endurece.
Permanece bastante blando tras el secado y se puede trabajar fácilmente con herramientas metálicas.
El sulfato de calcio hemihidratado (CaSO4 ∙ ½H2O) reacciona con el agua para formar sulfato de calcio dihidratado y, cuando se calienta, el sulfato de calcio dihidratado separa el agua y la intercambia por sulfato de calcio hemihidratado.
La ruptura del CaSO4 ∙ 2H2Ocristalino se debe a las bicapas de CaSO4(en cada capa los iónicos Ca2 + y SO4 2 están alternativamente uno al lado del otro) con enlaces de hidrógeno relativamente bajos.
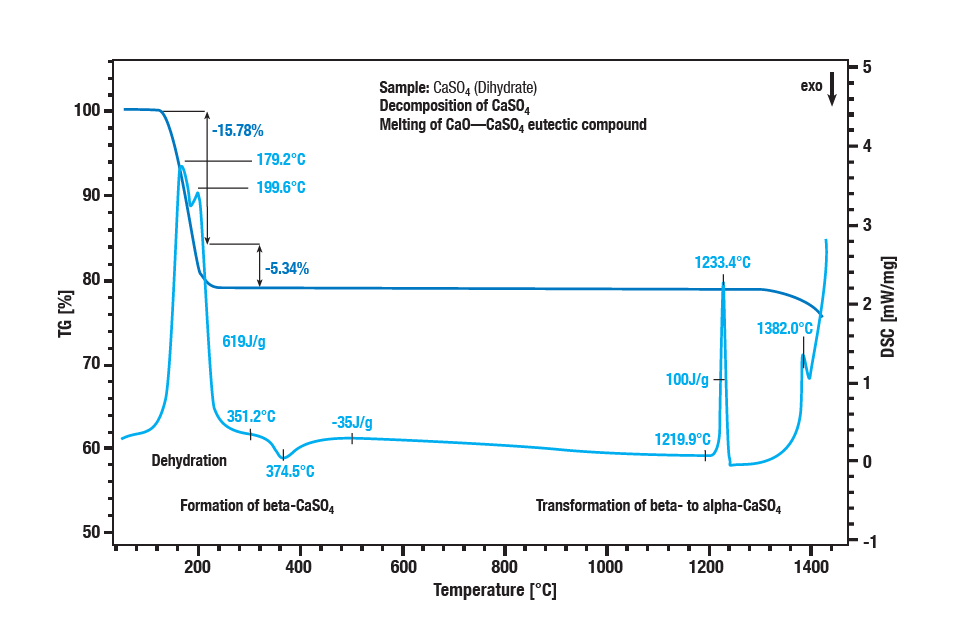
La deshidratación en dos etapas del sulfato cálcico dihidratado se produce entre 100 °C y 300 °C.
En la primera etapa se forma el hemihidrato ( CaSO4 ∙ 2H2Oa CaSO4 ∙ ½H2O).
Una deshidratación posterior forma el anhidrato ( CaSO4 ½ H2Oa CaSO 4).
Con un efecto exotérmico a unos 340 °C, el anhidrato se convierte en β-sulfato cálcico.
El efecto exotérmico en la curva a aprox. 1220 °C es la conversión del β-sulfato cálcico en α-sulfato cálcico.
La descomposición del sulfato se caracteriza por una mayor pérdida de masa a temperaturas superiores a 1250 °C.
El sulfato de calcio se convierte en óxido de calcio.
La fusión de una mezcla eutéctica de sulfato de calcio y óxido de calcio alcanza su punto máximo a 1380 °C.

