Tecnología del hidrógeno y análisis térmico
Índice
Energía verde – Ciclo del hidrógeno – Economía del hidrógeno
Una clave esencial para la energía y la movilidad ecológicas es el uso del hidrógeno como combustible, para almacenamiento de energía y como herramienta para los procesos de transferencia de energía.
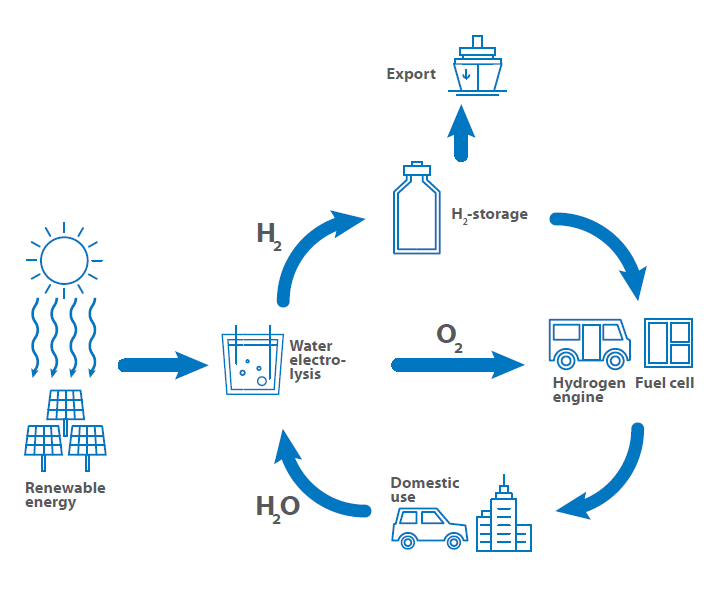
Por este motivo, se ha establecido el llamado ciclo del hidrógeno, que muestra la utilización del hidrógeno desde su producción, pasando por su almacenamiento y exportación, hasta su uso como combustible de vuelta a la producción.
Puesto que hay muchos caminos para cada paso de este ciclo, se han creado algunos conceptos de investigación para colmar lagunas y acceder a técnicas que son necesarias y aún no están totalmente desarrolladas.
El sitio Organización de Investigación Fraunhofer ha desarrollado y publicado una hoja de ruta del hidrógeno para Alemania, en la que se presentan todas las áreas y temas de investigación.
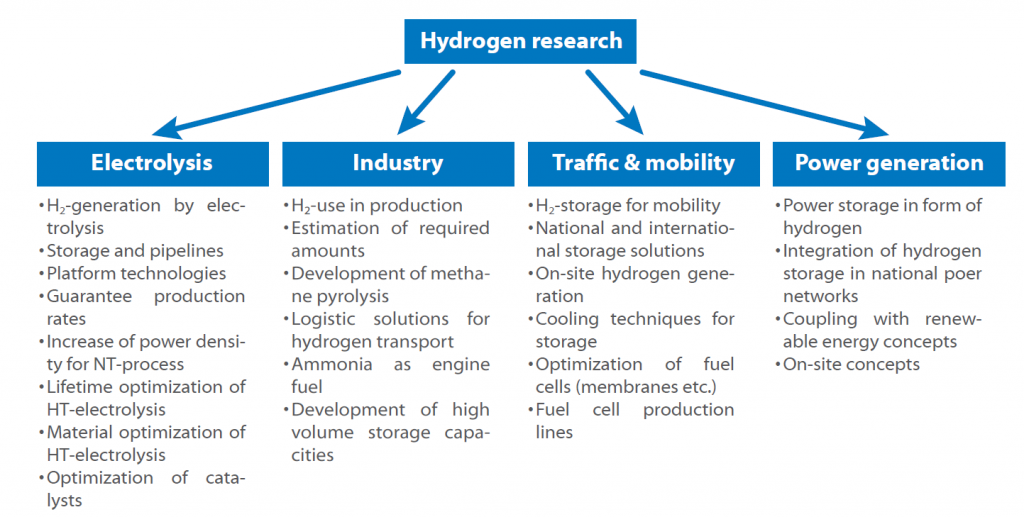
La hoja de ruta muestra el posible uso del hidrógeno en un futuro próximo.
La cuestión clave es siempre el almacenamiento y la producción, ya que todos los sectores se ven afectados por la cuestión de cómo almacenar el hidrógeno de forma segura y eficiente.
Otra cuestión a la que hay que dar respuesta es si es más prometedora la producción centralizada o descentralizada de hidrógeno y si debe utilizarse como combustible directamente o en forma de amoníaco o sustancias similares.
1. ciclo del hidrógeno – fuentes de energía renovables
El ciclo del hidrógeno comienza con la producción de hidrógeno mediante centrales eléctricas ecológicas.
Las fuentes más importantes para la producción de energía renovable son las centrales hidroeléctricas, los aerogeneradores, los sistemas fotovoltaicos, las centrales geotérmicas y las centrales de biomasa, con el objetivo de generar energía en cantidades suficientes sin emisiones de CO2 y sin residuos nucleares.
El análisis térmico y la ciencia de los materiales están presentes en todas las áreas:
- De la investigación de materiales compuestos, como los utilizados en las palas de los aerogeneradores
- a la optimización material de los materiales semiconductores en las células fotovoltaicas
- hasta la optimización de la producción directa de hidrógeno a partir de aplicaciones de biomasa.

Ejemplo de aplicación: comportamiento de dilatación térmica de materiales ligeros
Un buen ejemplo de dónde entra en juego el análisis térmico en el campo de las energías renovables es el comportamiento de expansión térmica de comportamiento de expansión de materiales ligeros, como los materiales compuestos para palas de aerogeneradores:
Los materiales compuestos se utilizan en la construcción ligera o como materiales de construcción especiales para muchos fines. Por ejemplo, laspalas de los aerogeneradores se fabrican con aleaciones ligeras de aluminio o polímeros ligeros.
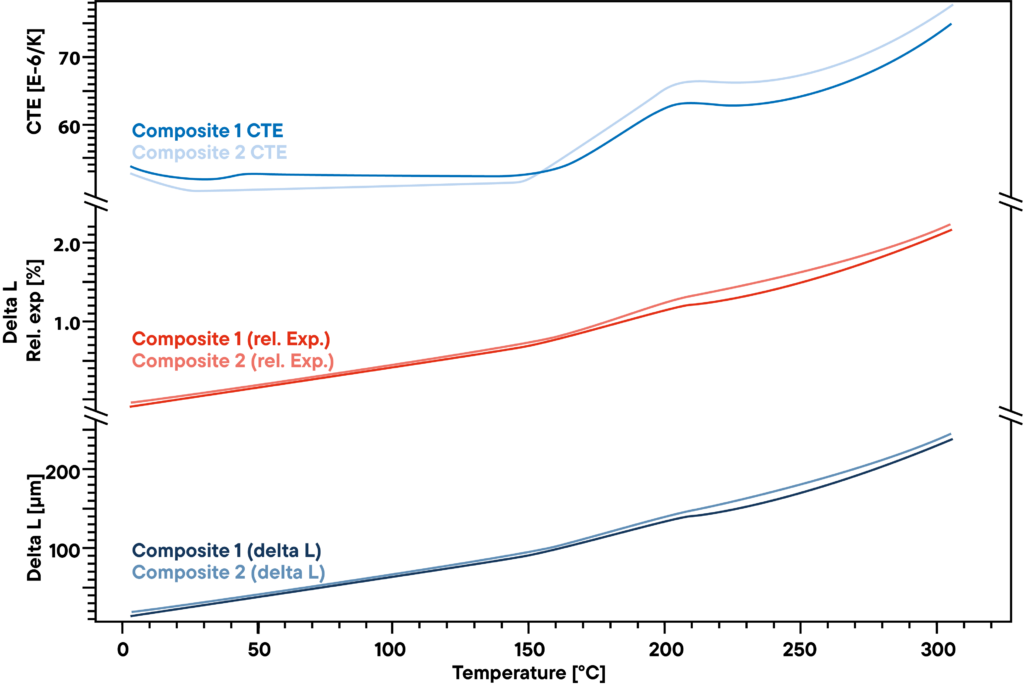
La medición muestra la pequeña diferencia en dos compuestos poliméricos utilizados para estructuras rígidas pero ligeras, como las palas de los aerogeneradores.
El delta L absoluto medido con un dilatómetro de varilla de empuje Linseis a una velocidad de calentamiento constante de 5 K/min (curva inferior) no muestra diferencias grandes entre las dos muestras analizadas.
La dilatación relativa (curvas rojas) también es muy similar.
Sin embargo, hay una ligera diferencia que se hace visible al observar el CET.
Antes del punto de transformación, a unos 200°C, hay un pequeño efecto que sólo se aprecia en una de las dos muestras e indica otra pequeña transformación o cambio de fase que el otro material no muestra.
Ejemplo de aplicación: DEA – Análisis dieléctrico / control del curado
Para una producción rentable y de alta calidad de materiales compuestos, es de vital importancia conocer tanto el tiempo exacto como el perfil de temperatura necesarios para completar la pieza específica.
Si estos parámetros se seleccionan incorrectamente, o bien no se puede conseguir la calidad o se ha malgastado dinero.
Este proceso de curado puede controlarse mediante DEA -Análisis Dieléctrico- si los tiempos de espera son demasiado largos.
El curado de la mayoría de los polímeros puede observarse con sensores DEA, que se introducen en el material sin curar.
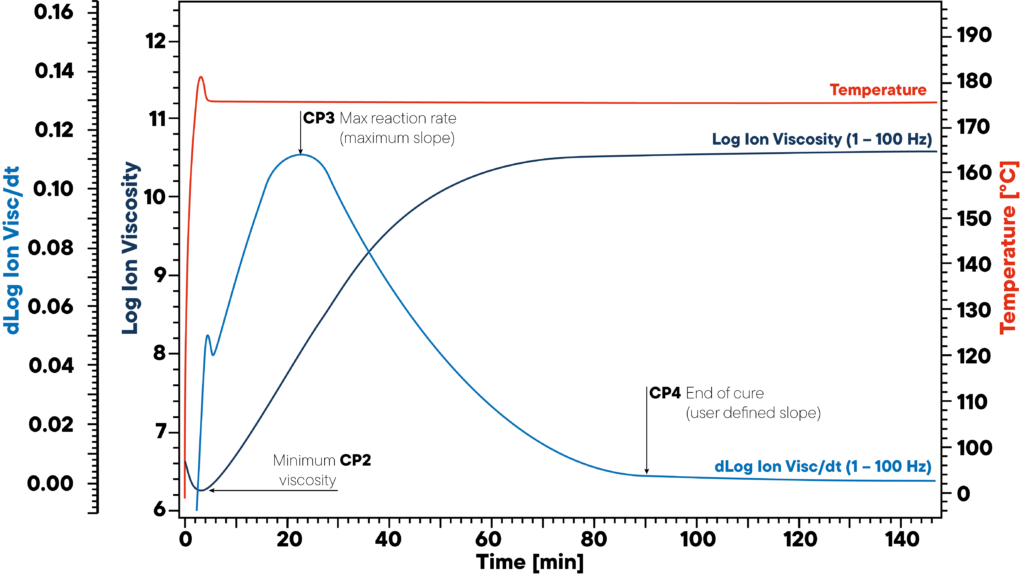
En el ejemplo, la resina se calienta isotérmicamente a 180 °C y se acopla un sensor DEA.
La curva roja muestra la temperatura isotérmica de la muestra y del sensor.
Se controlan la viscosidad iónica y la pendiente de la viscosidad iónica.
Los tres puntos significativos CP2, CP3 y CP4 marcan el inicio (viscosidad mínima), la velocidad máxima de reacción (pendiente máxima) y el final del curado.
Esta información es crucial para el correcto curado de los polímeros, ya que los materiales no curados pueden provocar graves problemas de calidad.
Ejemplo de aplicación: Calidad y comportamiento de las materias primas, por ejemplo, la biomasa.
Otro punto importante para la producción de hidrógeno es la calidad y el comportamiento de las materias primas, por ejemplo, la biomasa utilizada para generar electricidad e hidrógeno.
 La cuestión es cuánto hidrógeno se puede obtener a partir de distintas materias primas durante la gasificación, cuánta energía se necesita para ello y cómo es el resultado global. Esto puede controlarse mediante termogravimetría de presión y termogravimetría y calorimetría combinadas (STA), como se muestra en el siguiente ejemplo de aplicación.
La cuestión es cuánto hidrógeno se puede obtener a partir de distintas materias primas durante la gasificación, cuánta energía se necesita para ello y cómo es el resultado global. Esto puede controlarse mediante termogravimetría de presión y termogravimetría y calorimetría combinadas (STA), como se muestra en el siguiente ejemplo de aplicación.
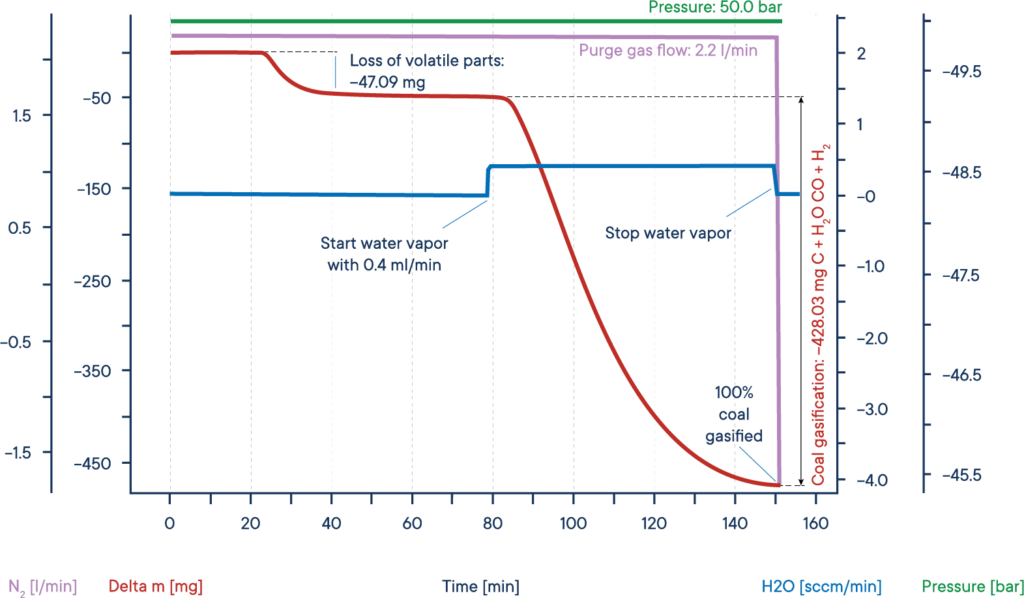
Una aplicación típica de las mediciones TGA de alta presión es la investigación de la llamada gasificación del carbón o hidrogasificación.
Este proceso, en el que el carbón se calienta en una atmósfera de vapor de agua, se utiliza en procesos catalíticos, por ejemplo para eliminar el monóxido de carbono de los gases de escape y, sobre todo, para extraer compuestos orgánicos valiosos de recursos como el carbón vegetal o la biomasa.
El ejemplo dado muestra una prueba típica de gasificación de biomasa seca. La muestra de biomasa se calentó hasta una meseta isotérmica bajo una atmósfera de nitrógeno a una presión de 50 bares (TGA de alta presión – termobalanza).
La señal de masa muestra la pérdida de volátiles entre 20 y 40 min.
Tras la adición de vapor de agua, la biomasa se gasificó y se consumió casi por completo al cabo de 150 min, dando lugar a H2, CO, CH3OH y otros gases reactivos útiles, como muestra la curva roja de pérdida de masa.
El proceso completo puede describirse como sigue: El carbono reacciona con el vapor de agua para formar una mezcla de monóxido de carbono e hidrógeno.
El monóxido de carbono resultante puede reaccionar con una segunda molécula de agua para formar dióxido de carbono y más hidrógeno, y finalmente el hidrógeno resultante puede formar metano y otros hidrocarburos a partir del monóxido de carbono.
Ejemplo de aplicación: Investigación del comportamiento de combustión y del contenido en cenizas de los materiales compuestos
 Por último, pero no por ello menos importante, los materiales compuestos deben reciclarse o utilizarse para la recuperación de energía al final de la vida útil del producto.
Por último, pero no por ello menos importante, los materiales compuestos deben reciclarse o utilizarse para la recuperación de energía al final de la vida útil del producto.
Para ello, puede ser interesante investigar el comportamiento de la combustión y el contenido de cenizas.
Los materiales carbonosos, las sustancias orgánicas y los polímeros suelen quemarse cuando se calientan.
Por ello, el estudio de la descomposición térmica de estos materiales es algo especializado.
En la mayoría de los casos, se lleva a cabo en atmósferas inertes en lugar de aire para ver los efectos de la descomposición y la pirólisis, seguidos del intercambio gaseoso con oxígeno o aire, que da lugar a la combustión del carbono contenido.
Si este proceso se lleva a cabo en un analizador térmico combinado (STA), se puede medir el contenido de carbono, el contenido inorgánico y el calor liberado.
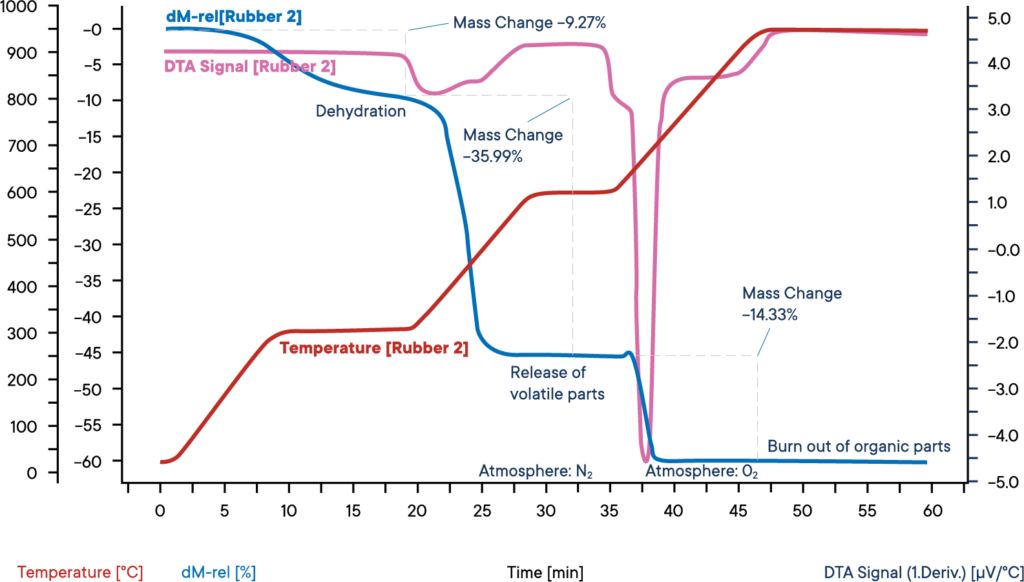
Esta medición de una muestra de caucho industrial se realizó con una termobalanza simultánea STA PT 1600, partiendo de una atmósfera de nitrógeno.
La muestra se calentó en tres pasos, cada uno a 30 K/min.
La curva azul muestra la pérdida de peso relativa.
La deshidratación de la muestra tiene lugar en la primera pérdida de peso.
El contenido de agua era del 9,3%.
La señal DTA correspondiente (curva morada) no mostró ningún efecto durante la evaporación del agua.
En el segundo paso de la reacción, los componentes volátiles se liberan por pirólisis en una atmósfera de N2.
La proporción de estos componentes es del 36,0 %.
Su liberación se reconoce por un pico de reacción exotérmica en la curva DTA.
Para el tercer paso de la reacción, se cambia la atmósfera a O2, lo que provoca la combustión del carbono restante.
La pérdida de peso es del 14,3 %.
El 40,4 % restante son componentes inorgánicos como cenizas, escorias o cargas.
2. conversión de la energía eléctrica en energía química (electrólisis, combustibles sintéticos)
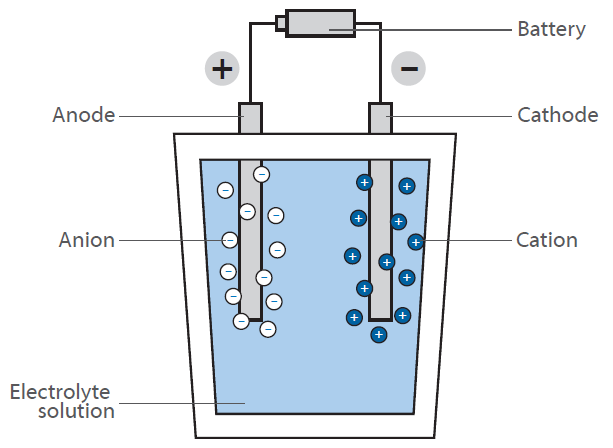
La electrólisis del agua es la división química del agua en oxígeno e hidrógeno mediante la aplicación de una tensión externa.
Como este proceso de producción de hidrógeno requiere mucha energía, también se utilizan procesos que producen hidrógeno mediante catalizadores o cadenas de reacción, como la gasificación del carbón.
Sin embargo, el objetivo es conseguir una electrólisis directa de alto rendimiento y eficacia.
Para mejorar la eficacia de la electrólisis, hay que optimizar los materiales del cátodo y del ánodo, así como los catalizadores y los materiales de superficie.
Como la energía eléctrica es difícil de almacenar, las grandes centrales actuales, como las de carbón y las nucleares, producen una cantidad continua de energía para cubrir la carga base, mientras que las centrales más variables, como las de gas, se utilizan para compensar las fluctuaciones.
Como la generación de electricidad a partir de fuentes de energía renovables está sujeta a fluctuaciones (por ejemplo, por la noche, durante la sequía o cuando no hay viento), la energía generada debe almacenarse para cubrir la necesidad de una demanda energética continua y fluctuante con la generación intermitente de las fuentes de energía renovables.
Además, algunas aplicaciones, como movilidad (coches, camiones, aviones de largo alcance), requieren grandes cantidades de energía.
Almacenar la energía eléctrica en acumuladores no es práctico, ya que los acumuladores del tamaño necesario son caros y no están listos para usar.
Para estas aplicaciones, es más favorable convertir la energía eléctrica en energía química en forma de combustibles sintéticos o hidrógeno.
Como los combustibles sintéticos también se producen con hidrógeno, el paso más importante es la producción de hidrógeno a partir de agua mediante electrólisis.
Ejemplo de aplicación: Catalizadores – Dilatación térmica de los hilos de platino
 El análisis térmico puede ayudar aquí caracterizando los materiales utilizados en términos de estabilidad química, conductividad térmica y capacidad de sorción, pero también determinando la expansión térmica para mejorar la vida útil y la calidad.
El análisis térmico puede ayudar aquí caracterizando los materiales utilizados en términos de estabilidad química, conductividad térmica y capacidad de sorción, pero también determinando la expansión térmica para mejorar la vida útil y la calidad.
El platino se utiliza como catalizador, como material puro o en muchas aleaciones.
Como el uso como aleación es el más común debido a las diversas ventajas que tiene una aleación, el comportamiento físico y químico cambia ligeramente.
El ejemplo muestra la diferencia de dilatación térmica entre el platino y el platino con un 3 % de rodio.
En el ejemplo, el platino y una aleación de platino se midieron en un dilatómetro de varilla de empuje Linseis con una velocidad de calentamiento lineal de 5 K/min.
Las dos curvas inferiores muestran la dilatación térmica absoluta, las curvas superiores muestran la dilatación relativa de una muestra de platino en comparación con una aleación de platino y rodio.
Aunque sólo haya una ligera diferencia en la composición química, el comportamiento de dilatación muestra una desviación de unos pocos μm en el rango de hasta 1000 °C.
Cuando se utiliza en una estructura compleja, como un reactor, deben tenerse en cuenta los valores exactos de dilatación para evitar daños en la unidad de electrólisis debidos a coeficientes de dilatación diferentes.

Ejemplo de aplicación: Gestión térmica – conductividad térmica del grafito
Además de la dilatación térmica, que puede causar problemas en una estructura compleja, también son muy importantes las propiedades termofísicas, como la conductividad térmica y la resistencia específica.
 La clave es una correcta gestión térmica. Si no hay grandes diferencias de temperatura dentro del reactor, no habrá problemas de dilatación térmica.
La clave es una correcta gestión térmica. Si no hay grandes diferencias de temperatura dentro del reactor, no habrá problemas de dilatación térmica.
Por eso , también es bueno conocer las propiedades de transporte térmico de todos los materiales utilizados.
En resumen: Optimizar las propiedades termofísicas ayuda a ahorrar costes y mejorar la calidad.
Los catalizadores nanoestructurados, por ejemplo, tienen una mayor superficie activa y requieren menos materia prima.
El grafito es un tipo de carbono que se presenta como un sólido gris oscuro.
Tiene una resistencia química notablemente alta y se utiliza de muchas formas distintas, por ejemplo, como material catódico, material de construcción, componente de sensores y mucho más.
Cuando se calienta, reacciona con el oxígeno para formar monóxido de carbono o dióxido de carbono, pero puede alcanzar temperaturas muy elevadas cuando se calienta en un entorno inerte y sin oxígeno, por lo que se utiliza como material para hornos o incluso como calentador en hornos de temperatura ultraelevada.
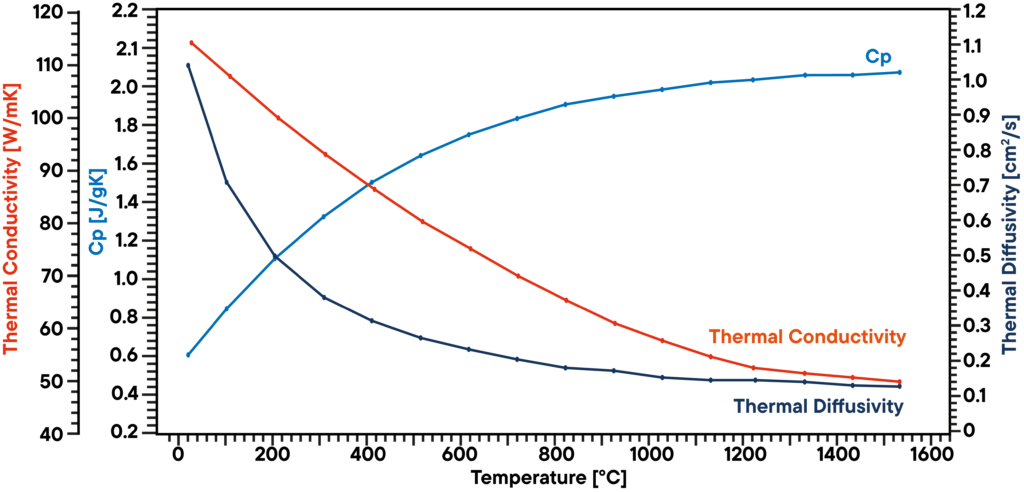
En este ejemplo, se analizó una muestra de grafito en vacío utilizando un LFA 1000 (Laserflash Analyzer).
La difusividad térmica se midió directamente en varios pasos de temperatura entre RT y 1100°C.
La capacidad calorífica específica se determinó con un patrón de grafito conocido en una segunda posición de la muestra como referencia en la misma medición.
El producto de la difusividad térmica, el calor específico y la densidad da la conductividad térmica correspondiente.
El resultado muestra una conductividad térmica linealmente decreciente, lo que es típico, y una difusividad térmica que muestra una meseta por encima de 500°C.
El valor Cp aumenta ligeramente con la temperatura.
Ejemplo de aplicación: Combustible sintético – reacciones dependientes de la presión debido a la alta presión STA
Para algunas aplicaciones, como los aviones, puede ser ventajoso unir la energía eléctrica en una forma más estable que el hidrógeno, que es lo que son los combustibles sintéticos.
Los combustibles sintéticos tienen la gran ventaja de que las infraestructuras y construcciones existentes pueden utilizarse sin cambios.
La idea es utilizar hidrógeno verde y producir hidrocarburos sintéticos a partir de él.
El CO2 se captura de la atmósfera durante el proceso de producción, pero el CO2 se libera de nuevo cuando se utiliza (quema) el combustible sintético.
El proceso de producción de combustibles sintéticos (proceso Fischer-Tropsch) puede optimizarse con sistemas TG y TG/DSC de alta presión, como el LINSEIS High Pressure -STA.
La serie STA HP de Linseis permite realizar mediciones bajo presión controlada y elevada.
En algunas reacciones, como la descomposición, la adsorción y la desorción, el comportamiento de las muestras y los materiales depende en gran medida de las condiciones atmosféricas, ya que en muchas reacciones existe una dependencia de la presión.
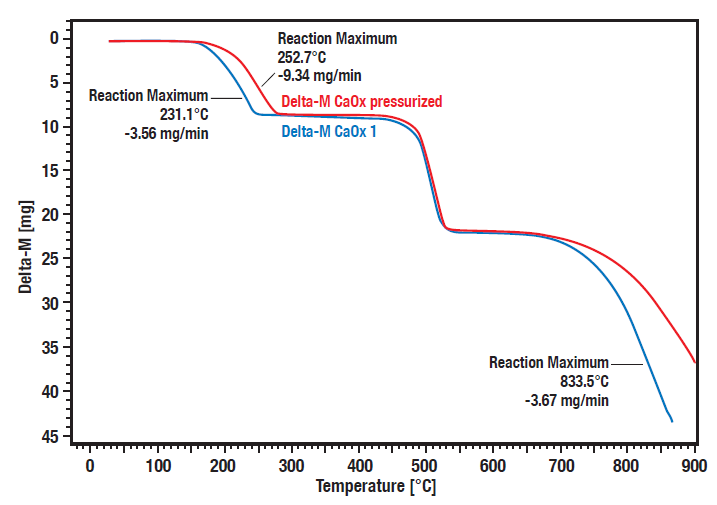
Estas curvas muestran la medición comparativa de la descomposición del hidrato de oxalato cálcico bajo presión (20 bares, curva roja) frente a condiciones atmosféricas (curva azul).
Puede reconocerse una clara dependencia de la presión de los pasos de descomposición 1 (pérdida de agua) y 3 (pérdida de dióxido de carbono).
Los pasos de descomposición 1 y 3 se desplazan a temperaturas más altas a mayor presión.
El segundo paso es la conversión irreversible del oxalato orgánico en carbonato inorgánico con liberación de monóxido de carbono.
Como esto no es reversible, no depende de la presión.
3. almacenamiento de hidrógeno
Como el hidrógeno es un gas muy volátil, su almacenamiento y transporte constituyen un gran reto.
Se puede almacenar en cilindros comprimiendo el gas H2, pero se prefieren otras tecnologías debido a la alta presión necesaria (hay cilindros con una presión máxima de hasta 700 bares) y a los problemas tecnológicos y de seguridad asociados (el hidrógeno se difunde a través de cualquier material con el tiempo).
Por ejemplo, el hidrógeno puede almacenarse por sorción en diversos materiales en los que está más o menos fijado químicamente (marcos metalorgánicos (MOF), zeolitas, líquidos iónicos, etc.). Sin embargo, el almacenamiento como hidruro metálico es el más prometedor.
En este caso, el hidrógeno se une químicamente a una superficie metálica formando el hidruro estable.
Este proceso puede optimizarse aumentando la superficie mediante el uso de materiales porosos, como zeolitas y andamios sintéticos con nanoporos.
En muchos materiales, el hidrógeno puede liberarse después mediante cambios controlados de temperatura o cambios de presión fácilmente aplicables.
Ya no existe el riesgo de difusión incontrolada.
Ejemplo de aplicación: Sorción STA a alta presión
 Análisis térmicos, en particular nálisisanálisis gravimétricospueden ayudar a determinar las condiciones exactas de sorción y las velocidades de liberación y almacenamiento para optimizar los ciclos de carga y liberación.
Análisis térmicos, en particular nálisisanálisis gravimétricospueden ayudar a determinar las condiciones exactas de sorción y las velocidades de liberación y almacenamiento para optimizar los ciclos de carga y liberación.
La medición de la sorción, que se realiza mediante métodos volumétricos, no suele proporcionar ninguna información sobre el flujo de calor y la entalpía.
Si interesa conocer el calor de sorción, se requiere un segundo experimento.
El analizador gravimétrico de sorción (TG-DSC de alta presión), que mide tanto el cambio de peso (termogravimetría TGA) como la señal de la calorimetría diferencial de barrido (DSC), ofrece una alternativa mucho más rápida.
En un ensayo pueden medirse tanto la capacidad de adsorción como el calor de adsorción.
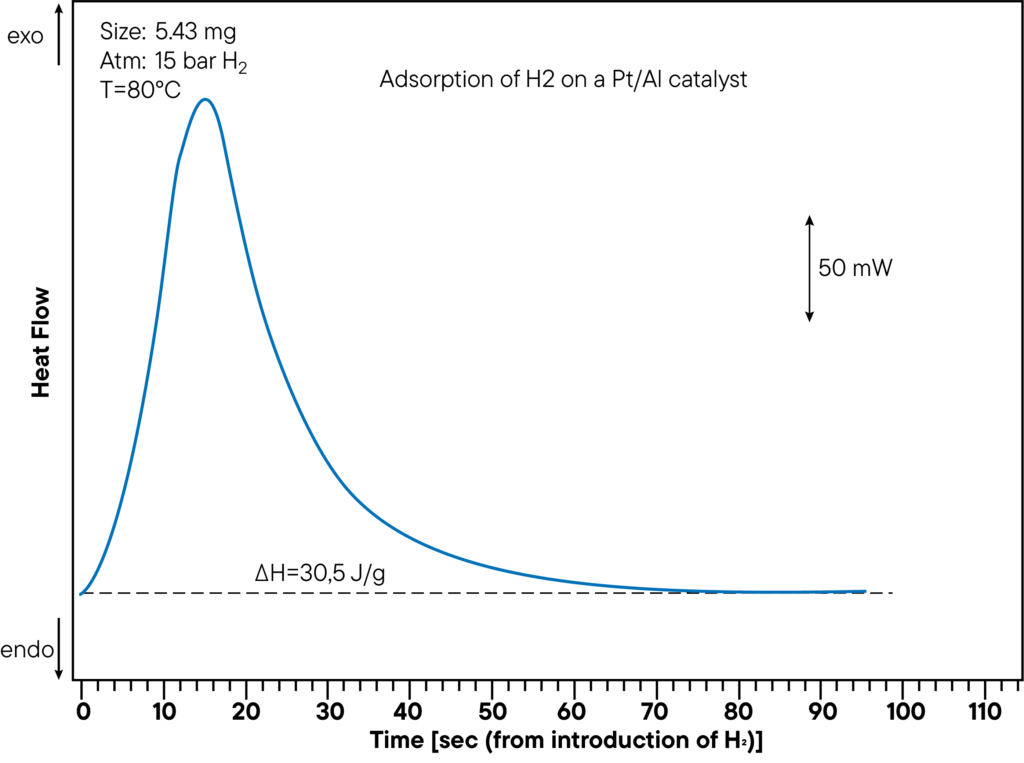
La figura muestra la sección de medición DSC de la adsorción de hidrógeno en un catalizador de Pt/Al a una presión de 15 bares y una temperatura de 80°C.
El calor generado es de 30,5 J/g.
El calor de sorción se determinó directamente durante el experimento de sorción y muestra un pico claro.
En la curva anterior, se controló el tiempo transcurrido desde la inyección de hidrógeno hasta la reacción de sorción, para mostrar la rapidez con la que la muestra interactúa con la atmósfera.
4. dispositivos y procesos que utilizan el hidrógeno como combustible
Una vez que el hidrógeno se ha producido y almacenado y está disponible para su uso (móvil), su alta densidad energética permite una gran variedad de aplicaciones.
Los usos más comunes son como agente reductor, combustible, gas portador y para sintetizar moléculas como hidratos de carbono, amoníaco y muchas más. Una aplicación frecuente es la sinterización de metales.
Las piezas metálicas o que contienen óxidos metálicos se fabrican a menudo compactando polvos en los llamados cuerpos verdes. Estos cuerpos verdes se solidifican posteriormente calentándolos a una temperatura inferior al punto de fusión, proceso conocido como sinterización.
Durante la sinterización, se reducen las dimensiones.
Por consiguiente, el proceso de sinterización puede analizarse midiendo las dimensiones. Esto suele hacerse en un dilatómetro (ver ejemplo de aplicación).
Para evitar la oxidación y también para reducir el contenido de óxidos en el producto final, la sinterización puede tener lugar en una atmósfera que contenga hidrógeno o incluso en una atmósfera de hidrógeno puro.
Gracias a su experiencia en tecnología de seguridad del hidrógeno, LINSEIS puede suministrar dilatómetros para su uso en atmósferas de hidrógeno puro.
El dilatómetro puede utilizarse para mediciones de sinterización o expansión de hidrógeno en atmósferas reductoras.
Está acoplado a una unidad de combustión de seguridad y el sistema está conectado a un detector de hidrógeno que puede desconectar el sistema y purgarlo con gas inerte en caso de liberación incontrolada de hidrógeno.
Ejemplo de aplicación: Sinterización H2 de polvos metálicos
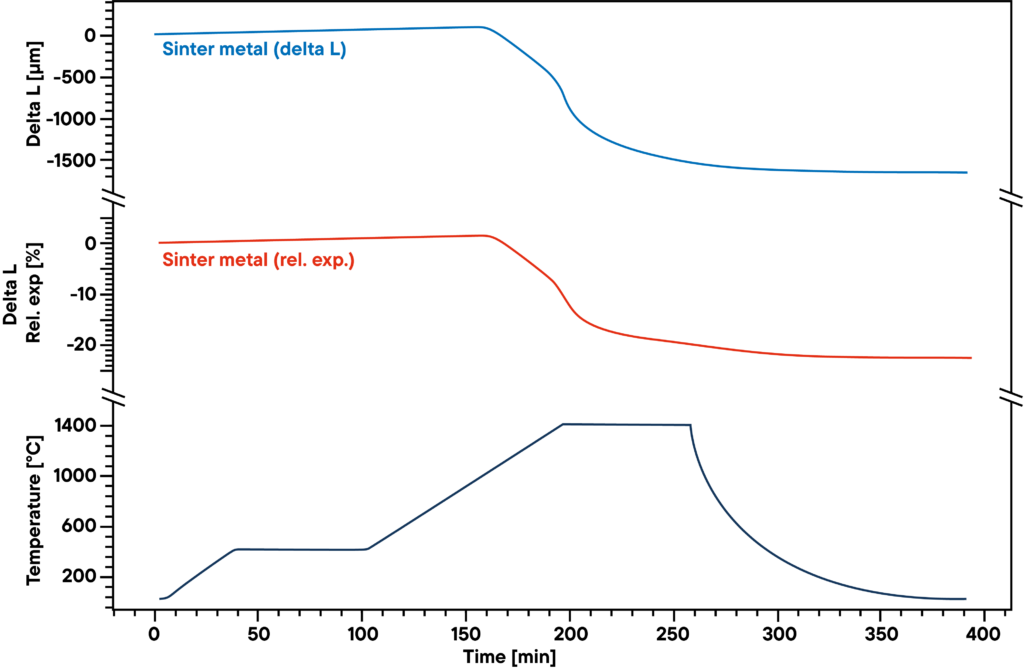
El ejemplo muestra la sinterización por hidrógeno de cuerpos verdes de polvo metálico que se utilizan como catalizadores.
La medición muestra la curva de sinterización del polvo metálico sinterizado prensado, que se calentó en una atmósfera de hidrógeno absoluto según el perfil de sinterización (curva inferior).
El hidrógeno reduce el oxígeno contenido en la muestra durante el proceso de sinterización y da lugar a una mayor densidad y un menor contenido de óxido metálico.
Por lo tanto, tanto la atmósfera de gas como el perfil de sinterización influyen significativamente en los resultados.
La curva azul muestra la expansión y contracción relativas, la curva roja muestra los valores absolutos.
El principal paso de sinterización se observa en la segunda fase de calentamiento, entre 500°C y 1400°C.
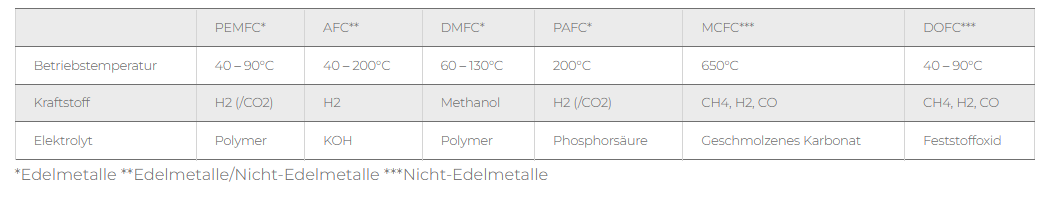
5. tecnología de pilas de combustible
Sin embargo, las aplicaciones más interesantes y mencionadas con más frecuencia del hidrógeno son las pilas de combustible, que pueden utilizarse en muchas situaciones diferentes, desde suministrar electricidad y calor a los edificios hasta propulsar coches con mayor autonomía.
Son la pieza clave para convertir la energía almacenada del hidrógeno de nuevo en electricidad.
En una pila de combustible, el hidrógeno reacciona con el aire para formar agua.
Esta reacción no se aprovecha directamente por combustión con desprendimiento de calor, sino en una pila de combustible para generar energía eléctrica: El diagrama muestra una representación esquemática de una pila de combustible de hidrógeno.
Su función es generar energía eléctrica «a demanda» mediante la reacción del hidrógeno y el oxígeno.
A diferencia de la reacción clásica, directa, en la que se forma agua con una gran liberación de energía en forma de calor (imagina una mezcla gaseosa de hidrógeno y oxígeno que se enciende), una pila de combustible tiene dos cámaras en las que se encuentran los dos compuestos.
En el centro de estas cámaras hay una membrana que permite la difusión del hidrógeno, pero no de otras moléculas.
En la superficie de la membrana, en el lado de la cámara de oxígeno, tiene lugar la reacción del hidrógeno y el oxígeno, produciendo agua que sale de la célula.
Esto provoca una disminución de la concentración de hidrógeno en la membrana y hace que más moléculas de hidrógeno migren a la membrana.
La difusión del hidrógeno en la cámara que contiene oxígeno genera una tensión eléctrica en la membrana.
Ésta es la energía que ahora se libera en lugar de calor y puede utilizarse para hacer funcionar un motor.
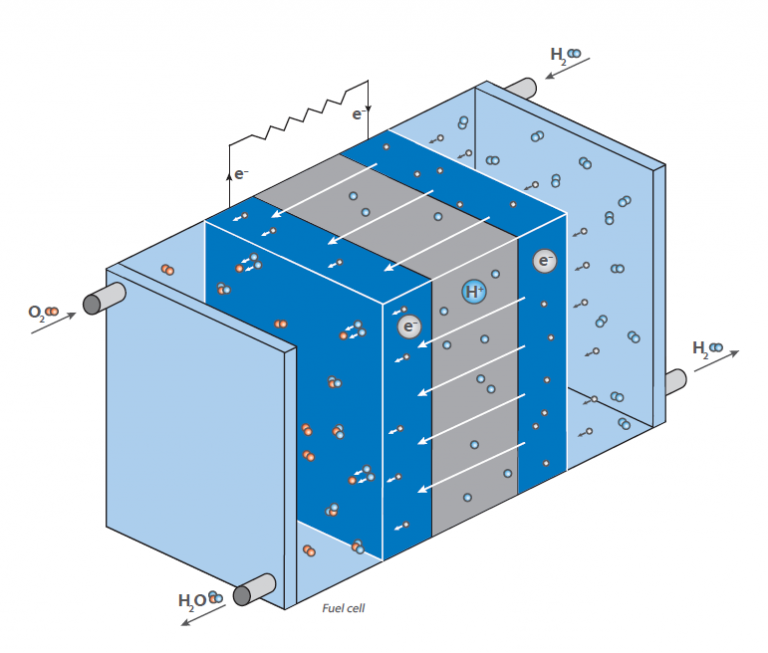
Como la concentración de hidrógeno en la cámara de hidrógeno puede regularse, la velocidad de difusión en la membrana puede controlarse fácilmente, como en un motor de gasolina.
Por tanto, el hidrógeno puede considerarse un «combustible».
La membrana está recubierta de un material de electrodo formado por metales preciosos.
Estos metales actúan como catalizadores e influyen en las condiciones de trabajo de la pila de combustible (temperatura, tensión, etc.).
Como las pilas de combustible alimentadas con hidrógeno pueden funcionar a temperaturas elevadas, de hasta 1000°C, y la soldadura utilizada para ensamblarlas debe ser estable desde el punto de vista térmico, químico y mecánico, aquí es donde vuelve a entrar en juego el análisis térmico.
Las condiciones de funcionamiento de las pilas de combustible dependen de los materiales utilizados, que pueden actuar como catalizadores.
Por ejemplo, todas las técnicas utilizadas para caracterizar los catalizadores tienen aplicaciones en la tecnología de las pilas de hidrógeno/combustible.
En consecuencia, se necesitan muchos conocimientos en ciencia de materiales y muchas técnicas analíticas para analizar los materiales.
En este caso, nos centraremos en las técnicas de análisis térmico.
Algunas aplicaciones de almacenamiento de hidrógeno funcionan a alta presión, a veces superior a 100 bares, por lo que son útiles los analizadores presurizados.
Además, todas las técnicas de análisis requieren precauciones debido a la alta reactividad del hidrógeno con el oxígeno/aire.
En consecuencia, todos los analizadores deben estar equipados con dispositivos de seguridad para evitar el riesgo de explosiones.
Ejemplo de aplicación: Liberación de hidrógeno del almacenamiento en superficie
El siguiente ejemplo de aplicación muestra cómo se utilizan los dispositivos de análisis térmico y ciencia de materiales en el campo de las pilas de combustible.
El almacenamiento de hidrógeno puede adoptar la forma de adsorción superficial, adsorción en poros o absorción química.
Para la mayoría de los metales, la adsorción superficial es la vía más prometedora, ya que es fácil de conseguir y la liberación de hidrógeno puede controlarse muy bien.
Por ello, se están investigando muchos metales con una elevada superficie específica.
El hidruro de titanio es una fuente de hidrógeno de uso frecuente para la liberación controlada de hidrógeno en diversas reacciones.
Por un lado, puede utilizarse como catalizador en química líquida in situ como fuente de hidrógeno y, por otro, en baterías o pilas de combustible para la liberación controlada de hidrógeno, por ejemplo.
Para tener una idea de qué cantidad de hidrógeno se libera a qué temperatura, es importante conocer el comportamiento de descomposición en función de la temperatura y la cantidad de calor liberado, que puede controlarse mediante el análisis térmico simultáneo (STA).
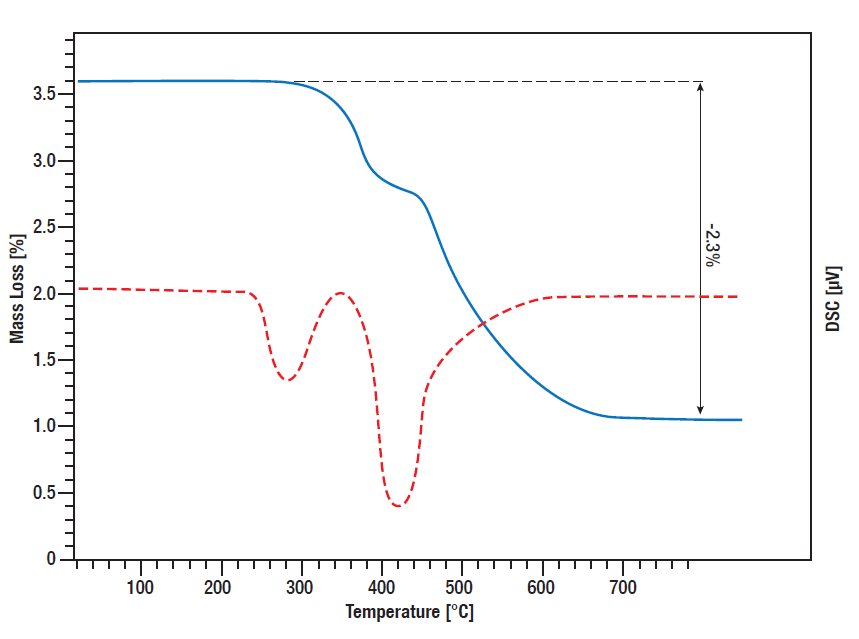
En esta medición STA se controló la liberación de hidrógeno por el hidruro de titanio.
Se midieron las señales TG y DSC desde la temperatura ambiente hasta 800°C mientras la muestra se calentaba linealmente en atmósfera de argón a 10 K/min.
Entre 300°C y 600°C se produce una pérdida de masa en dos etapas por un total del 2,3%, lo que significa que toda la cantidad de hidrógeno ligado se libera en este proceso.
La curva DSC muestra los picos de desorción correspondientes (curva roja).
Seguridad en las mediciones de hidrógeno
El hidrógeno tiene una gran afinidad por los agentes oxidantes y las superficies metálicas, así como por el oxígeno.
La formación de agua a partir de los elementos (2 – H2 + O 2 = 2 – H2O; ΔH = 286 kJ/mol) es una reacción exotérmica, por lo que el hidrógeno se considera un potente almacén de energía.
Las mezclas de hidrógeno-aire con un contenido de hidrógeno superior al 4% aproximadamente son potencialmente explosivas.
La energía de activación (sin catalizador) es alta, pero en presencia de una llama, una chispa o una temperatura elevada tales mezclas pueden arder o explotar.
Por lo tanto, se requieren algunas precauciones de seguridad para cualquier análisis térmico con concentraciones de hidrógeno superiores al 4% en el aire.
Todos los analizadores térmicos LINSEIS para aplicaciones de hidrógeno pueden equiparse con las siguientes características de seguridad:

- Detectores de hidrógeno: detectan cualquier fuga en las tuberías de gas.
Estos detectores se colocan cerca del aparato y detectan cualquier fuga o escape accidental de hidrógeno. - Purga con gas inerte: Si se detecta una fuga y se interrumpe el suministro de hidrógeno, el hidrógeno residual del analizador se purga con gas inerte.
- Válvulas de seguridad: En cuanto se detecta una fuga de hidrógeno, las válvulas de seguridad se activan e interrumpen el suministro de hidrógeno al analizador térmico.
- Unidad de residuos para la desgasificación: Todos los sistemas de hidrógeno Linseis están equipados con una unidad de antorcha en la conexión de desgasificación.
Los gases de salida (gas de muestra, gas de purga y productos de descomposición) pasan a través de la llama encendida constantemente para garantizar que no se liberan gases inflamables al medio ambiente y que pueden alcanzar una concentración crítica en el laboratorio.
La unidad de llama se calienta eléctricamente y tiene un mecanismo de seguridad que impide que la llama retroceda hacia los conductos de gas.
