Wasserstoff-technologie und thermische Analyse
Table of Contents
Grüne Energie – Wasserstoffkreislauf – Wasserstoffwirtschaft
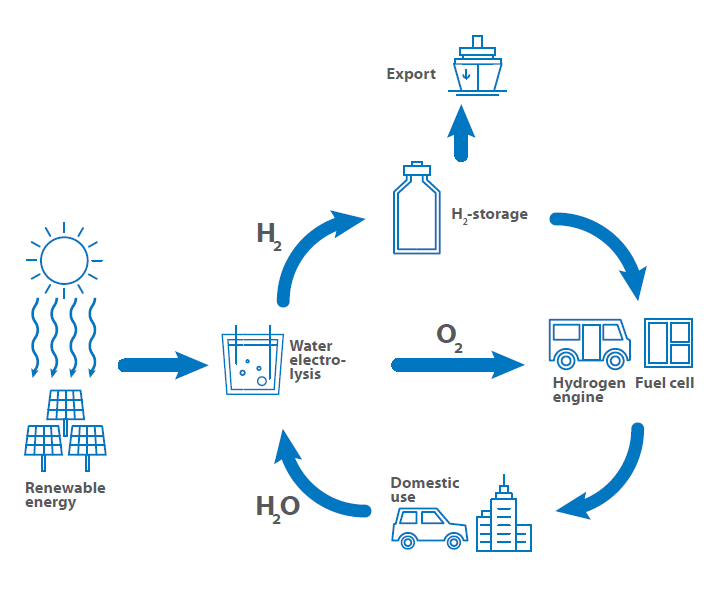
Ein wesentlicher Schlüssel zu grüner Energie und Mobilität ist die Nutzung von Wasserstoff als Kraftstoff, zur Energiespeicherung und als Werkzeug für Energietransferprozesse. Daher wurde der sogenannte Wasserstoffkreislauf etabliert, der die Nutzung von Wasserstoff von der Erzeugung über die Speicherung und den Export bis hin zur Nutzung als Kraftstoff zurück zur Erzeugung zeigt.
Da es für jeden Schritt in diesem Kreislauf viele Wege gibt, wurden einige Forschungskonzepte erstellt, um Lücken zu schließen und Zugang zu Techniken zu bekommen, die notwendig und noch nicht ausgereift sind. Die Fraunhofer-Forschungsgesellschaft hat eine Wasserstoff-Roadmap für Deutschland entwickelt und veröffentlicht, in der alle Forschungsbereiche und Themen dargestellt sind.
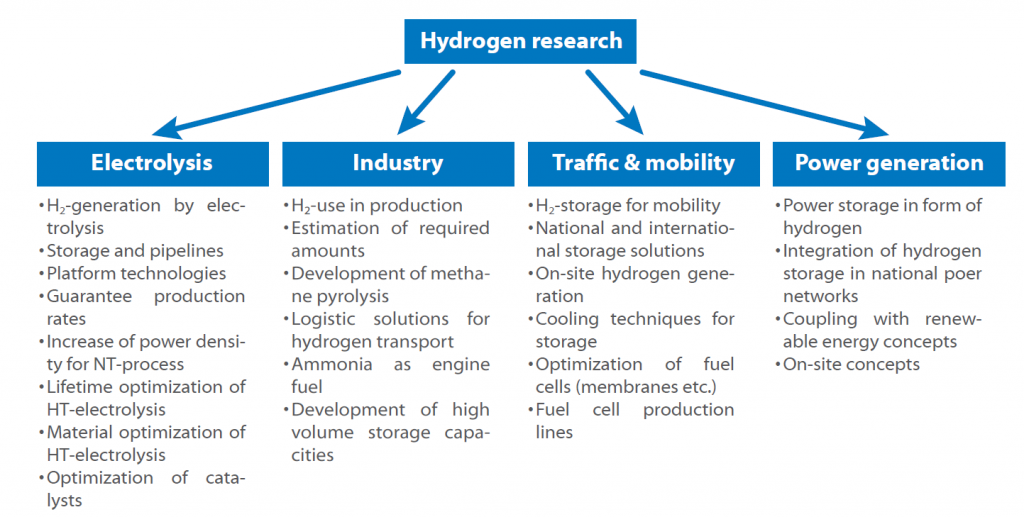
Die Roadmap zeigt den möglichen Einsatz von Wasserstoff in der nahen Zukunft. Das Schlüsselthema ist immer die Speicherung und Produktion, da jeder Sektor von der Frage betroffen ist, wie man Wasserstoff sicher und effizient speichern kann.
Eine weitere Frage, die es zu beantworten gilt, ist, ob eine zentrale oder dezentrale Wasserstofferzeugung erfolgversprechender ist und ob er als Kraftstoff direkt oder in Form von Ammoniak oder ähnlichen Stoffen genutzt werden soll.
1. Wasserstoffkreislauf – Erneuerbare Energiequellen
Der Wasserstoffkreislauf beginnt mit der Wasserstofferzeugung durch grüne Kraftwerke. Zu den wichtigsten Quellen für die Gewinnung erneuerbarer Energie gehören Wasserkraftwerke, Windräder, Photovoltaikanlagen, geothermische Anlagen und Biomasseanlagen mit dem Ziel, Energie in ausreichender Menge ohne CO2-Ausstoß und ohne Atommüll zu erzeugen.
Thermische Analyse und Materialwissenschaft sind in allen Bereichen präsent:
- Von der Forschung an Verbundwerkstoffen, wie sie bei Windradflügeln eingesetzt werden
- bis zur Materialoptimierung von Halbleitermaterialien in Photovoltaik-Zellen
- bis hin zur Optimierung der direkten Wasserstofferzeugung aus Biomasseanwendungen.

Anwendungsbeispiel: Thermisches Ausdehnungsverhalten von Leichtbau-Materialien
Ein gutes Beispiel, bei dem die thermische Analyse im Bereich der erneuerbaren Energien zum Tragen kommt, ist das thermische Ausdehnungsverhalten von Leichtbaumaterialien wie z.B. Verbundwerkstoffen für Windradflügel:
Verbundwerkstoffe werden im Leichtbau oder als Sonderbaustoffe für viele Zwecke eingesetzt.
Zum Beispiel werden die Flügel von Windrädern aus leichten Aluminiumlegierungen oder leichten Polymeren hergestellt.
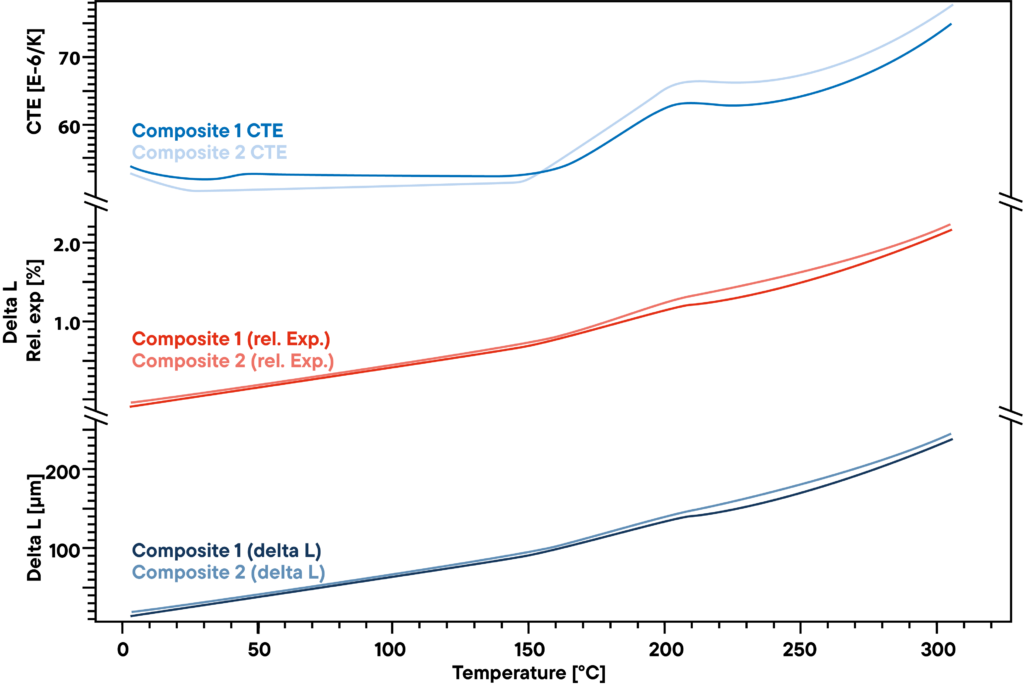
Die Messung zeigt den geringen Unterschied bei zwei Polymerverbundwerkstoffen, die für steife, aber leichte Konstruktionen wie Windradflügel verwendet werden. Das absolute Delta L, das mit einem Linseis Schubstangendilatometer bei konstanter Erwärmung mit einer linearen Rate von 5 K/min gemessen wurde (untere Kurve), zeigt keinen großen Unterschied zwischen den beiden untersuchten Proben. Auch die relative Ausdehnung (rote Kurven) ist sehr ähnlich.
Es gibt jedoch einen leichten Unterschied, der bei der Betrachtung des CTEs sichtbar wird. Vor dem Umwandlungspunkt bei ca. 200°C gibt es einen kleinen Effekt, der nur bei einer der beiden Proben zu sehen ist und auf eine weitere kleine Umwandlung oder Phasenänderung hinweist, die das andere Material nicht zeigt.
Anwendungsbeispiel: DEA – Dielektrische Analyse / Aushärtungsüberwachung
Für eine kosteneffiziente und qualitativ hochwertige Produktion von Verbundwerkstoffen ist es von höchster Wichtigkeit, sowohl das genaue Zeit- als auch das Temperaturprofil zu kennen, das für die Fertigstellung des spezifischen Teils erforderlich ist.
Wenn diese Parameter falsch gewählt werden, kann entweder die Qualität nicht erreicht werden oder es wurde Geld verschwendet. Dieser Prozess der Aushärtung kann durch zu lange Wartezeiten mittels DEA – Dielektrische Analyse – überwacht werden.
Die Aushärtung der meisten Polymere kann mit DEA-Sensoren beobachtet werden, die in das unausgehärtete Material eingebracht werden.
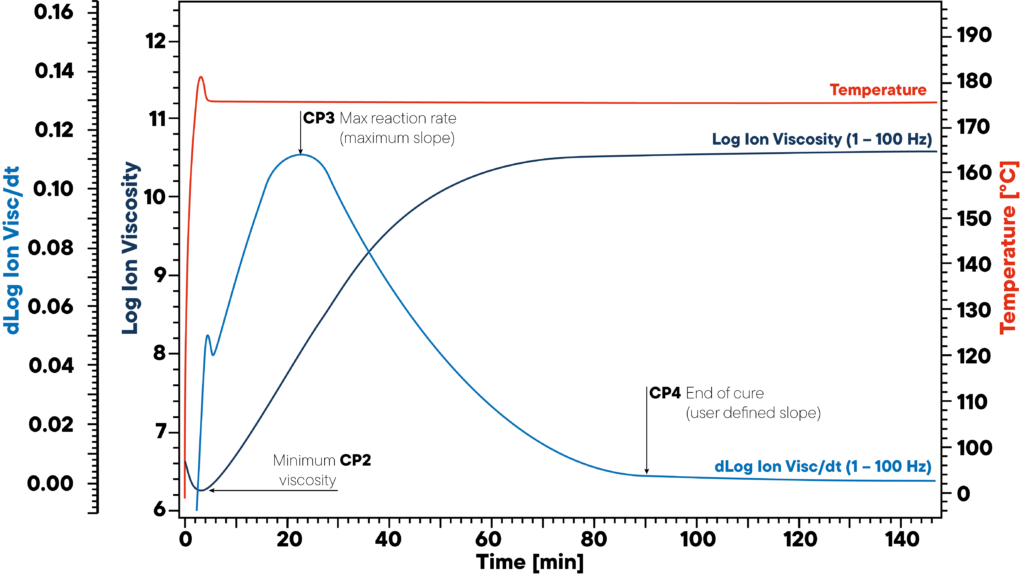
Im Beispiel wird das Harz isotherm auf 180 °C erhitzt und ein DEA-Sensor angebracht. Die rote Kurve zeigt die isotherme Temperatur der Probe und des Sensors. Die Ionenviskosität und die Steigung der Ionenviskosität werden überwacht.
Die drei signifikanten Punkte CP2, CP3 und CP4 markieren den Beginn (minimale Viskosität), die maximale Reaktionsgeschwindigkeit (maximale Steigung) und das Ende der Aushärtung. Diese Informationen sind entscheidend für die korrekte Polymeraushärtung, da unausgehärtete Materialien zu schwerwiegenden Qualitätsproblemen führen können.
Anwendungsbeispiel: Qualität und Verhalten der Rohstoffe, z. B. Biomasse
Ein weiterer wichtiger Punkt für die Herstellung von Wasserstoff ist die Qualität und das Verhalten der Rohstoffe, z.B. der eingesetzten Biomasse zur Strom- und Wasserstofferzeugung.
 Die Frage ist, wie viel Wasserstoff aus verschiedenen Rohstoffen bei der Vergasung gewonnen werden kann, wie viel Energie dafür benötigt wird und wie das Gesamtergebnis aussieht. Dies kann durch Druckthermogravimetrie und kombinierte Thermogravimetrie und Kalorimetrie (STA) überwacht werden, wie im folgenden Anwendungsbeispiel gezeigt wird.
Die Frage ist, wie viel Wasserstoff aus verschiedenen Rohstoffen bei der Vergasung gewonnen werden kann, wie viel Energie dafür benötigt wird und wie das Gesamtergebnis aussieht. Dies kann durch Druckthermogravimetrie und kombinierte Thermogravimetrie und Kalorimetrie (STA) überwacht werden, wie im folgenden Anwendungsbeispiel gezeigt wird.
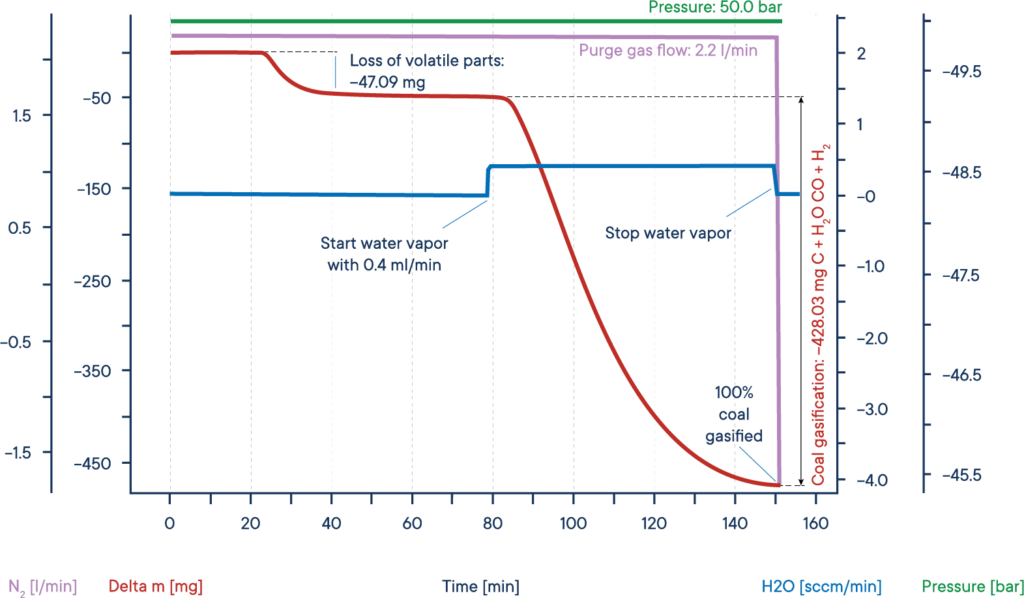
Eine typische Anwendung für Hochdruck-TGA-Messungen ist die Untersuchung der sogenannten Kohlevergasung oder Hydrovergasung. Dieser Prozess, bei dem Kohlenstoff in einer Wasserdampfatmosphäre erhitzt wird, wird in katalytischen Prozessen eingesetzt, zum Beispiel um Kohlenmonoxid aus Abgasen zu entfernen und speziell um wertvolle organische Verbindungen aus Ressourcen wie Holzkohle oder Biomasse herauszuholen.
Das angegebene Beispiel zeigt einen typischen Vergasungsversuch von trockener Biomasse. Die Biomasseprobe wurde unter Stickstoffatmosphäre bei 50 bar Druck auf ein isothermes Plateau erhitzt (High Pressure TGA – Thermowaage).
Das Massensignal zeigt den Verlust der flüchtigen Bestandteile zwischen 20 und 40 min. Nach Zugabe von Wasserdampf wurde die Biomasse vergast und nach 150 min fast vollständig verbraucht, was zu H2, CO, CH3OH und anderen nützlichen reaktiven Gasen führte, wie die rote Massenverlustkurve zeigt.
Der gesamte Prozess kann wie folgt beschrieben werden: Kohlenstoff reagiert mit Wasserdampf zu einem Gemisch aus Kohlenmonoxid und Wasserstoff. Das erhaltene Kohlenmonoxid kann mit einem zweiten Wassermolekül zu Kohlendioxid und weiterem Wasserstoff reagieren und schließlich kann der entstehende Wasserstoff aus Kohlenmonoxid Methan und andere Kohlenwasserstoffe bilden.
Anwendungsbeispiel: Untersuchung von Brennverhalten und Aschegehalt von Verbundwerkstoffen
 Nicht zuletzt müssen die Verbundwerkstoffe nach dem Ende der Produktlebensdauer recycelt oder energetisch verwertet werden. Hierfür kann es von Interesse sein, das Brennverhalten und den Aschegehalt zu untersuchen.
Nicht zuletzt müssen die Verbundwerkstoffe nach dem Ende der Produktlebensdauer recycelt oder energetisch verwertet werden. Hierfür kann es von Interesse sein, das Brennverhalten und den Aschegehalt zu untersuchen.
Kohlenstoffhaltige Materialien, organische Stoffe und Polymere brennen in der Regel beim Erhitzen ab. Die Untersuchung der thermischen Zersetzung solcher Materialien ist daher etwas speziell. In den meisten Fällen wird sie in inerten Atmosphären anstelle von Luft durchgeführt, um Zersetzungseffekte und Pyrolyse sehen zu können, gefolgt von einem Gaswechsel zu Sauerstoff oder Luft, was zu einem Abbrand des enthaltenen Kohlenstoffs führt.
Wird dieser Vorgang an einem kombinierten thermischen Analysator (STA) durchgeführt, können der Kohlenstoffgehalt, der anorganische Anteil und die freigesetzte Wärme gemessen werden.
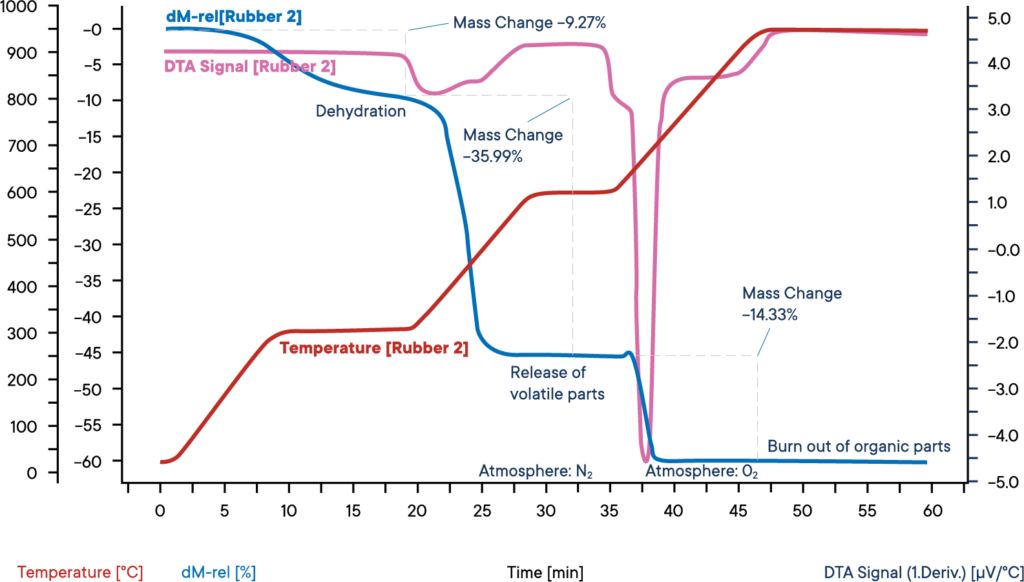
Diese Messung einer industriellen Gummiprobe wurde mit einer Simultanen Thermowaage STA PT 1600, beginnend bei Stickstoffatmosphäre, durchgeführt.
Die Probe wurde in drei Schritten mit jeweils 30 K/min aufgeheizt. Die blaue Kurve zeigt den relativen Gewichtsverlust. Im ersten Gewichtsverlust findet die Dehydratisierung der Probe statt. Der Wasseranteil betrug 9,3 %. Das entsprechende DTA-Signal (lila Kurve) zeigte keinen Effekt während der Verdampfung des Wassers.
Im zweiten Reaktionsschritt werden die flüchtigen Bestandteile durch Pyrolyse unter N2-Atmosphäre freigesetzt. Der Anteil dieser Komponenten beträgt 36,0 %. Ihre Freisetzung ist an einem exothermen Reaktionspeak auf der DTA-Kurve zu erkennen.
Für den dritten Reaktionsschritt wird die Atmosphäre auf O2 umgestellt, was zu einem Abbrand des restlichen Kohlenstoffs führt. Der Gewichtsverlust beträgt 14,3 %. Die restlichen 40,4 % sind anorganische Bestandteile wie Asche, Schlacke oder Füllstoffe.
2. Umwandlung von elektrischer in chemische Energie (Elektrolyse, Synthetische Brennstoffe)
Die Elektrolyse von Wasser ist die chemische Aufspaltung von Wasser in Sauerstoff und Wasserstoff durch Anlegen einer äußeren Spannung. Da dieser Prozess der Wasserstofferzeugung viel Energie benötigt, werden auch Verfahren eingesetzt, die Wasserstoff durch Katalysatoren oder Reaktionsketten wie z. B. Kohlevergasung erzeugen.
Das Ziel ist jedoch, eine direkte Elektrolyse mit hohem Durchsatz und Wirkungsgrad zu erreichen. Um die Effizienz der Elektrolyse zu verbessern, müssen die Kathoden- und Anodenmaterialien sowie die Katalysatoren und Oberflächenmaterialien optimiert werden.
Da sich elektrische Energie nur schwer speichern lässt, produzieren die heutigen Großkraftwerke, wie Kohle- und Kernkraftwerke, eine kontinuierliche Energiemenge, um die Grundlast zu decken, und variablere Kraftwerke, wie Gaskraftwerke, werden zum Ausgleich von Schwankungen eingesetzt.
Da die Stromerzeugung aus erneuerbaren Energien Schwankungen unterliegt (z. B. nachts, bei Trockenheit oder bei Windstille), muss die erzeugte Energie gespeichert werden, um den Bedarf an kontinuierlicher und schwankender Energienachfrage mit der diskontinuierlichen Erzeugung der erneuerbaren Energiequellen zu decken.
Darüber hinaus erfordern einige Anwendungen, wie z.B. Mobilität (Autos, LKWs, Flugzeuge mit hoher Reichweite), große Energiemengen. Die Speicherung der elektrischen Energie in Akkumulatoren ist nicht praktikabel, da Akkumulatoren in der benötigten Größe teuer und nicht betriebsbereit sind. Für diese Anwendungen ist es günstiger, die elektrische Energie in chemische Energie in Form von synthetischen Kraftstoffen oder Wasserstoff umzuwandeln. Da synthetische Kraftstoffe auch mit Wasserstoff hergestellt werden, ist der wichtigste Schritt die Herstellung von Wasserstoff aus Wasser durch Elektrolyse.
Anwendungsbeispiel: Katalysatoren – Thermische Ausdehnung von Platindrähten
 Die thermische Analyse kann hier helfen, indem sie die verwendeten Materialien hinsichtlich chemischer Stabilität, Wärmeleitfähigkeit und Sorptionsfähigkeit charakterisiert, aber auch die thermische Ausdehnung bestimmt, um Lebensdauer und Qualität zu verbessern.
Die thermische Analyse kann hier helfen, indem sie die verwendeten Materialien hinsichtlich chemischer Stabilität, Wärmeleitfähigkeit und Sorptionsfähigkeit charakterisiert, aber auch die thermische Ausdehnung bestimmt, um Lebensdauer und Qualität zu verbessern.
Platin wird als Katalysator, als reines Material oder in vielen Legierungen verwendet. Da die Verwendung als Legierung aufgrund verschiedener Vorteile, die eine Legierung hat, die häufigere Verwendung ist, ändert sich das physikalische und chemische Verhalten leicht. Das Beispiel zeigt den Unterschied in der Wärmeausdehnung zwischen Platin und Platin mit 3 % Rhodium.
In dem Beispiel wurden Platin und eine Platinlegierung in einem Linseis Schubstangendilatometer mit einer linearen Heizrate von 5 K/min gemessen. Die beiden unteren Kurven zeigen die absolute Wärmeausdehnung, die oberen Kurven zeigen die relative Ausdehnung einer Platinprobe im Vergleich zu einer Platin-Rhodium-Legierung.
Selbst bei einem nur geringen Unterschied in der chemischen Zusammensetzung zeigt das Ausdehnungsverhalten eine Abweichung von einigen μm im Bereich bis 1000 °C. Beim Einsatz in einer komplexen Struktur wie einem Reaktor müssen die exakten Ausdehnungswerte berücksichtigt werden, um Schäden an der Elektrolyseeinheit durch unterschiedliche Ausdehnungskoeffizienten zu vermeiden.

Anwendungsbeispiel: Wärmemanagement – Wärmeleitfähigkeit von Graphit
Neben der Wärmeausdehnung, die in einer komplexen Struktur Probleme verursachen kann, sind auch die thermophysikalischen Eigenschaften wie Wärmeleitfähigkeit und spezifischer Widerstand sehr wichtig.
 Der Schlüssel ist das richtige Wärmemanagement. Wenn es keine großen Temperaturunterschiede innerhalb des Reaktors gibt, gibt es auch keine Probleme mit der Wärmeausdehnung. Aus diesem Grund ist es gut, auch die thermischen Transporteigenschaften aller verwendeten Materialien zu kennen.
Der Schlüssel ist das richtige Wärmemanagement. Wenn es keine großen Temperaturunterschiede innerhalb des Reaktors gibt, gibt es auch keine Probleme mit der Wärmeausdehnung. Aus diesem Grund ist es gut, auch die thermischen Transporteigenschaften aller verwendeten Materialien zu kennen.
Zusammengefasst: Die Optimierung der thermophysikalischen Eigenschaften hilft, Kosten zu sparen und die Qualität zu verbessern. Nanostrukturierte Katalysatoren haben zum Beispiel eine größere aktive Oberfläche und benötigen weniger Rohmaterial.
Graphit ist eine Kohlenstoffart, die als dunkelgrauer Feststoff vorkommt. Er hat eine beachtlich hohe chemische Beständigkeit und wird vielseitig eingesetzt, z. B. als Kathodenmaterial, Baumaterial, Sensorbauteil und vieles mehr. Beim Erhitzen reagiert er mit Sauerstoff zu Kohlenmonoxid oder Kohlendioxid, kann jedoch sehr hohe Temperaturen erreichen, wenn er in inerter, sauerstofffreier Umgebung erhitzt wird und wird deshalb in Ultrahochtemperaturöfen als Ofenmaterial oder sogar als Heizer eingesetzt.
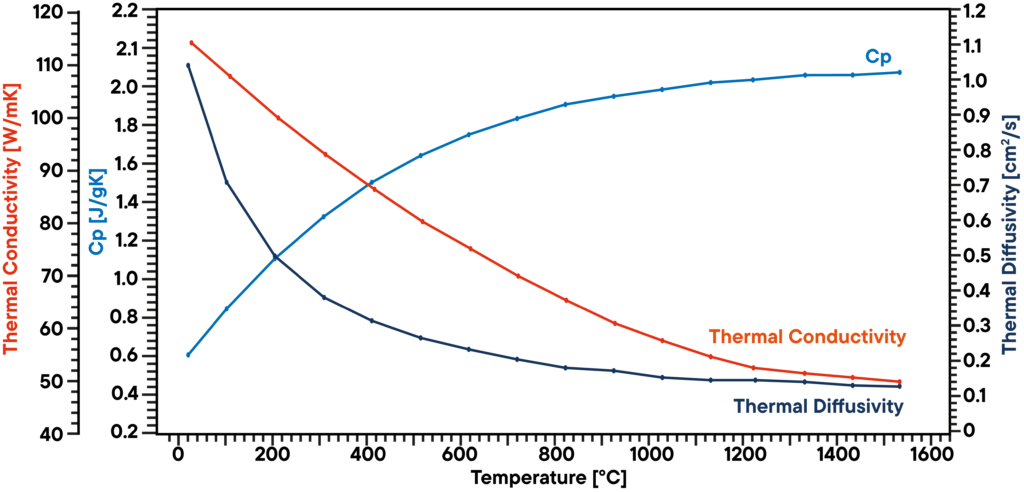
In diesem Beispiel wurde eine Graphitprobe im Vakuum mit einem LFA 1000 (Laserflash Analyzer) analysiert. Die Temperaturleitfähigkeit wurde direkt bei mehreren Temperaturschritten zwischen RT und 1100°C gemessen. Die spezifische Wärmekapazität wurde mit einem bekannten Graphitstandard in einer zweiten Probenposition als Referenz in der gleichen Messung bestimmt.
Das Produkt aus Temperaturleitfähigkeit, spezifischer Wärme und Dichte ergibt die entsprechende Wärmeleitfähigkeit. Das Ergebnis zeigt eine linear abnehmende Wärmeleitfähigkeit, was typisch ist, und eine Temperaturleitfähigkeit, die oberhalb von 500°C ein Plateau zeigt. Der Cp-Wert steigt mit der Temperatur leicht an.
Anwendungsbeispiel: Synthetischer Kraftstoff – Druckabhängige Reaktionen durch STA High Pressure
Für einige Anwendungen, wie z.B. Flugzeuge, kann es vorteilhaft sein, die elektrische Energie in einer stabileren Form als Wasserstoff zu binden, was synthetische Kraftstoffe sind.
Synthetische Kraftstoffe haben den großen Vorteil, dass bestehende Infrastrukturen und Konstruktionen unverändert genutzt werden können. Die Idee ist, den grünen Wasserstoff zu nutzen und daraus synthetische Kohlenwasserstoffe zu bilden. Bei der Bildung wird CO2 aus der Atmosphäre gebunden, aber bei der Nutzung (Verbrennung) des synthetischen Kraftstoffs wird das CO2 wieder freigesetzt.
Der Entstehungsprozess von synthetischen Kraftstoffen (Fischer-Tropsch-Prozess) kann mit Hochdruck-TG- und TG/DSC-Systemen wie dem LINSEIS High Pressure -STA optimiert werden.
Die Linseis STA HP-Serie ermöglicht Messungen unter kontrolliertem, erhöhtem Druck. Für einige Reaktionen wie Zersetzungen, Adsorption und Desorption ist das Verhalten von Proben und Materialien sehr stark von den atmosphärischen Bedingungen abhängig, da es bei vielen Reaktionen eine Druckabhängigkeit gibt.
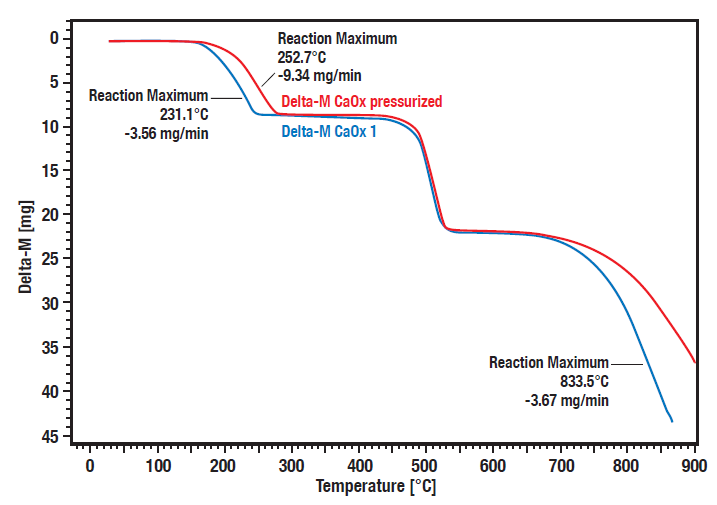
Diese Kurven zeigen die vergleichende Messung der Zersetzung von Calciumoxalat-Hydrat unter Druck (20 bar, rote Kurve) vs. atmosphärischen Bedingungen (blaue Kurve). Es ist eine deutliche Druckabhängigkeit der Zersetzungsschritte 1 (Verlust von Wasser) und 3 (Verlust von Kohlendioxid) zu erkennen.
Die Zersetzungsschritte 1 und 3 sind bei erhöhtem Druck zu höheren Temperaturen verschoben. Der zweite Schritt ist die irreversible Umwandlung von organischem Oxalat zu anorganischem Karbonat unter Freisetzung von Kohlenmonoxid. Da dies nicht reversibel ist, ist es nicht druckabhängig.
3. Wasserstoffspeicherung
Da Wasserstoff ein sehr flüchtiges Gas ist, ist seine Lagerung und sein Transport eine große Herausforderung. Er kann durch Kompression des H2-Gases in Flaschen gespeichert werden, aber aufgrund des erforderlichen hohen Drucks (es gibt Flaschen mit einem maximalen Druck von bis zu 700 bar) und der damit verbundenen technologischen und sicherheitsrelevanten Probleme (Wasserstoff diffundiert mit der Zeit durch jedes Material) werden andere Technologien bevorzugt.
Zum Beispiel kann Wasserstoff durch Sorption an verschiedenen Materialien gespeichert werden, wo er mehr oder weniger chemisch fixiert ist (metallorganische Gerüste (MOF), Zeolithe, ionische Flüssigkeiten etc.) Die Speicherung als Metallhydrid ist jedoch am vielversprechendsten.
In diesem Fall wird der Wasserstoff chemisch an eine Metalloberfläche gebunden, indem er das stabile Hydrid bildet. Dieser Prozess kann durch die Vergrößerung der Oberfläche durch den Einsatz von porösen Materialien wie Zeolithen und synthetischen Gerüsten mit Nanoporen optimiert werden. In vielen Materialien kann der Wasserstoff dann durch kontrollierte Temperaturänderungen oder einfach anzuwendende Druckänderungen freigesetzt werden. Die Gefahr der unkontrollierten Diffusion ist nicht mehr gegeben.
Anwendungsbeispiel: Hochdruck-STA-Sorption
Thermische A nalysen, insbesondere gravimetrische Analysen, können helfen, die genauen Sorptionsbedingungen, Freisetzungs- und Lagerungsraten zu ermitteln, um die Lade- und Freisetzungszyklen zu optimieren.
nalysen, insbesondere gravimetrische Analysen, können helfen, die genauen Sorptionsbedingungen, Freisetzungs- und Lagerungsraten zu ermitteln, um die Lade- und Freisetzungszyklen zu optimieren.
Die Messung der Sorption, die mit volumetrischen Methoden durchgeführt wird, gibt normalerweise keine Informationen über den Wärmestrom und die Enthalpie. Wenn die Sorptionswärme von Interesse ist, wird ein zweites Experiment benötigt.
Der gravimetrische Sorptionsanalysator (High Pressure TG-DSC), der sowohl die Gewichtsänderung (TGA Thermogravimetrie) als auch das (DSC) Differential Scanning Calorimetry- Signal misst, bietet eine wesentlich schnellere Alternative.
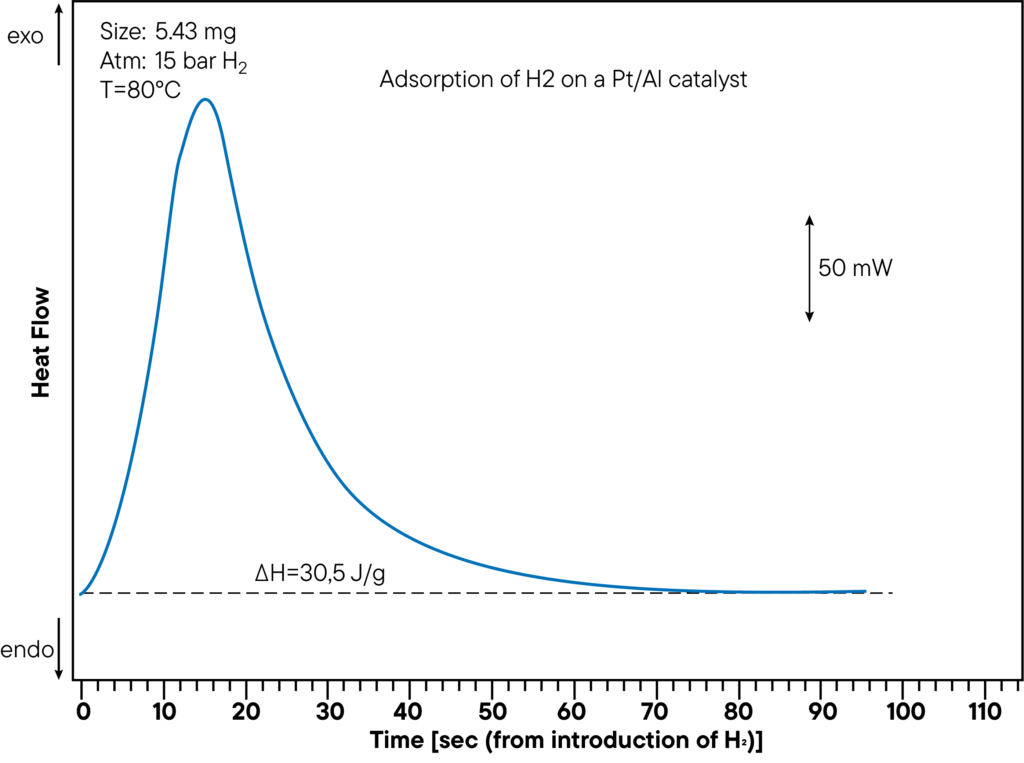
Innerhalb eines Versuchs können sowohl die Sorptionskapazität als auch die Sorptionswärme gemessen werden. Die Abbildung zeigt den DSC- Messteil der Adsorption von Wasserstoff an einem Pt/Al-Katalysator bei einem Druck von 15 bar und einer Temperatur von 80°C. Die entstehende Wärme beträgt 30,5 J/g. Die Sorptionswärme wurde direkt während des Sorptionsversuchs bestimmt und zeigt einen deutlichen Peak. In der obigen Kurve wurde die Zeit von der Wasserstoffeinleitung bis zur Sorptionsreaktion überwacht, um zu zeigen, wie schnell die Probe mit der Atmosphäre wechselwirkt.
4. Geräte und Verfahren, die Wasserstoff als Brennstoff verwenden
Ist der Wasserstoff einmal erzeugt und gespeichert und für den (mobilen) Einsatz verfügbar, ermöglicht seine hohe Energiedichte die verschiedensten Anwendungen.
Die gängigsten sind die Verwendung als Reduktionsmittel, Brennstoff, Trägergas und zur Synthese von Molekülen wie Kohlenhydraten, Ammoniak u.v.m. Eine häufig genutzte Anwendung ist das Sintern von Metallen.
Metallische oder metalloxidhaltige Werkstücke werden oft durch Verdichtung von Pulvern zu sogenannten Grünkörpern hergestellt. Diese Grünkörper werden später durch Erhitzen auf eine Temperatur unterhalb des Schmelzpunktes verfestigt, ein Vorgang, der als Sintern bezeichnet wird. Während des Sinterns kommt es zu einer Reduzierung der Abmessungen. Folglich kann der Sinterprozess durch Messung der Dimensionen untersucht werden. Dies geschieht üblicherweise in einem Dilatometer (siehe Anwendungsbeispiel).
Um Oxidation zu vermeiden und auch um den Gehalt an Oxiden im Endprodukt zu reduzieren, kann das Sintern in einer wasserstoffhaltigen Atmosphäre oder sogar in reiner Wasserstoffatmosphäre erfolgen.
Aufgrund seiner Kenntnisse in der Wasserstoff-Sicherheitstechnik ist LINSEIS in der Lage, Dilatometer für den Einsatz in reiner Wasserstoffatmosphäre zu liefern. Das Dilatometer kann für Wasserstoffsinter- oder Ausdehnungsmessungen in reduzierenden Atmosphären eingesetzt werden. Die Ausgasung ist mit einer Sicherheitsverbrennungseinheit gekoppelt und das System ist an einen Wasserstoffdetektor angeschlossen, der im Falle einer unkontrollierten Wasserstofffreisetzung das System abschalten und mit Inertgas spülen kann.
Anwendungsbeispiel: H2-Sintern von Metallpulvern
Das Beispiel zeigt das Wasserstoffsintern von Metallpulver-Grünkörpern, die als Katalysatoren eingesetzt werden.
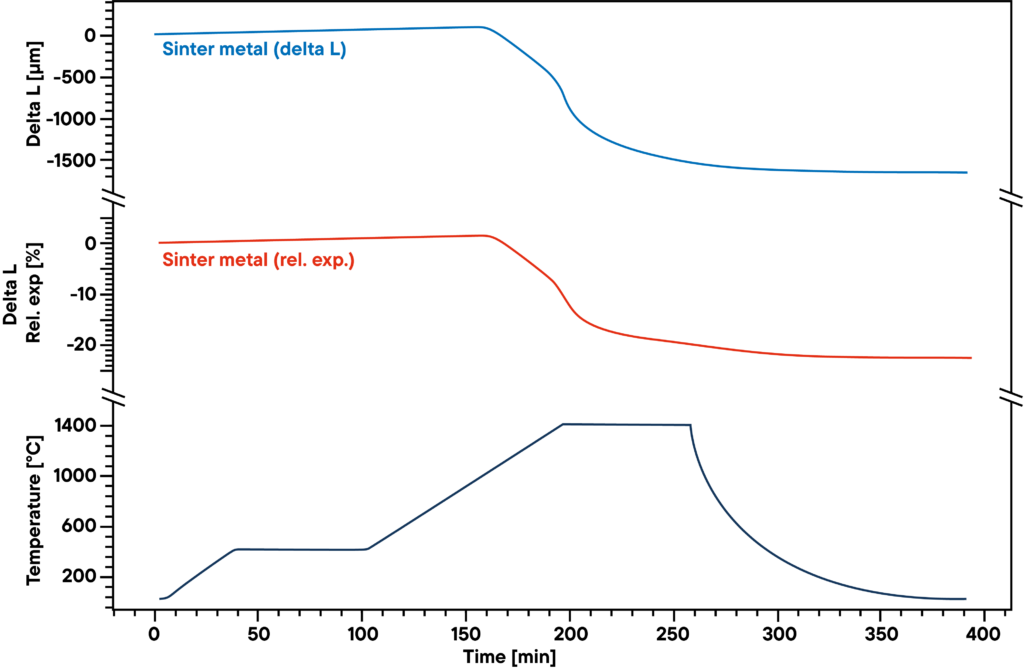
Die Messung zeigt die Sinterkurve von gepresstem Sintermetallpulver, das entsprechend dem Sinterprofil (untere Kurve) in absoluter Wasserstoffatmosphäre erhitzt wurde.
Der Wasserstoff reduziert den in der Probe enthaltenen Sauerstoff während des Sinterprozesses und bewirkt eine höhere Dichte und einen geringeren Metalloxidanteil. Daher haben sowohl die Gasatmosphäre als auch das Sinterprofil einen wesentlichen Einfluss auf die Ergebnisse.
Die blaue Kurve zeigt die relative Ausdehnung und Schrumpfung, die rote Kurve zeigt die absoluten Werte. Der Hauptsinterschritt ist in der zweiten Heizphase zwischen 500°C und 1400°C zu beobachten.
5. Brennstoffzellen-Technologie
Die interessantesten und am häufigsten genannten Anwendungen für Wasserstoff sind jedoch Brennstoffzellen, die in vielen verschiedenen Situationen eingesetzt werden können, von der Versorgung von Gebäuden mit Strom und Wärme bis zum Antrieb von Autos mit erhöhter Reichweite. Sie sind der Schlüsselteil bei der Rückumwandlung der gespeicherten Energie von Wasserstoff in Strom.
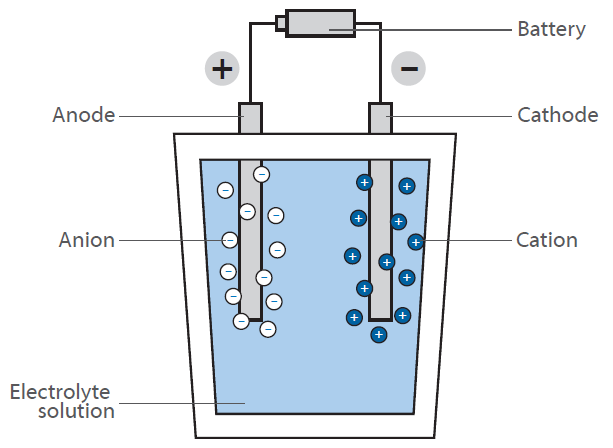
In einer Brennstoffzelle reagiert Wasserstoff mit Luft zu Wasser. Diese Reaktion wird nicht direkt durch Verbrennung unter Abgabe von Wärme genutzt, sondern in einer Brennstoffzelle zur Erzeugung elektrischer Energie: Das Schema zeigt eine schematische Darstellung einer Wasserstoff-Brennstoffzelle.
Sie hat die Aufgabe, durch die Reaktion von Wasserstoff und Sauerstoff elektrische Energie “on demand” zu erzeugen. Im Gegensatz zur klassischen, direkten Reaktion, bei der unter großer Energiefreisetzung in Form von Wärme Wasser gebildet wird (man stelle sich ein Wasserstoff-Sauerstoff-Gasgemisch vor, das gezündet wird), hat eine Brennstoffzelle zwei Kammern, in denen sich die beiden Verbindungen befinden.
In der Mitte dieser Kammern befindet sich eine Membran, die die Diffusion von Wasserstoff, nicht aber von anderen Molekülen erlaubt. An der Oberfläche der Membran auf der Seite der Sauerstoffkammer findet die Reaktion von Wasserstoff und Sauerstoff statt, wobei Wasser entsteht, das aus der Zelle herausgebracht wird. Dies führt zu einer Abnahme der Wasserstoffkonzentration an der Membran und bewirkt, dass mehr Wasserstoffmoleküle zur Membran wandern.
Durch die Diffusion von Wasserstoff in die sauerstoffhaltige Kammer wird an der Membran eine elektrische Spannung erzeugt. Dies ist die Energie, die nun anstelle von Wärme freigesetzt wird und zum Betrieb eines Motors genutzt werden kann.
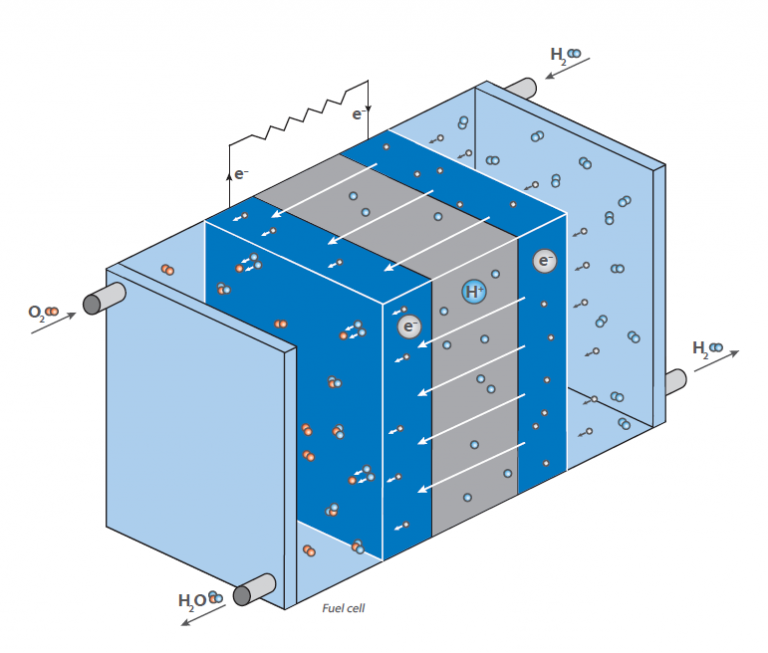
Da die Wasserstoffkonzentration an der Wasserstoffkammer geregelt werden kann, lässt sich die Diffusionsrate an der Membran wie bei einem benzinbetriebenen Motor leicht steuern. Der Wasserstoff kann daher als “Treibstoff” betrachtet werden. Die Membran ist mit einem Elektrodenmaterial bedeckt, das aus Edelmetallen besteht. Diese Metalle dienen als Katalysator und wirken auf die Arbeitsbedingungen der Brennstoffzelle (Temperatur, Spannung etc.).
Da wasserstoffbetriebene Brennstoffzellen bei hohen Temperaturen bis zu 1000°C arbeiten können und das für ihren Zusammenbau verwendete Lot thermisch, chemisch und mechanisch stabil sein muss, kommt hier wieder die Thermoanalyse ins Spiel. Die Arbeitsbedingungen der Brennstoffzellen hängen von den verwendeten Materialien ab, die als Katalysatoren wirken können.
So finden alle Techniken, die zur Charakterisierung von Katalysatoren verwendet werden, eine Anwendung in der Wasserstoff-/Brennstoffzellentechnologie. Folglich wird viel Wissen in der Materialwissenschaft benötigt und viele Analysetechniken helfen, die Materialien zu untersuchen. In diesem Fall werden wir uns auf thermische Analysetechniken konzentrieren.
Einige Wasserstoffspeicheranwendungen laufen unter hohem Druck, der manchmal 100 bar übersteigt, so dass druckbeaufschlagte Analysatoren nützlich sind. Zusätzlich benötigen alle Analysetechniken Vorsichtsmaßnahmen aufgrund der hohen Reaktivität von Wasserstoff zu Sauerstoff/Luft. Folglich müssen alle Geräte mit Sicherheitsfunktionen ausgestattet sein, um das Risiko von Explosionen zu vermeiden.
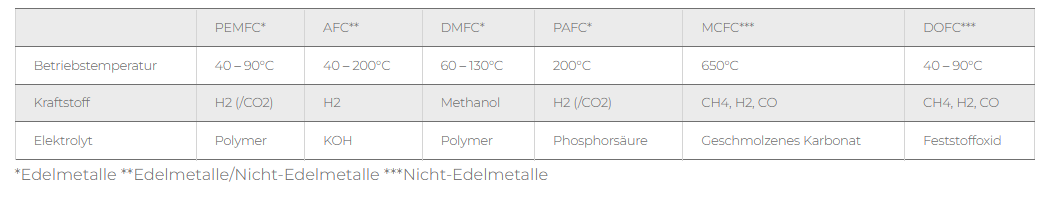
Anwendungsbeispiel: Wasserstoff-Freisetzung aus Oberflächenspeicher
Das folgende Anwendungsbeispiel zeigt, wo thermische Analyse und materialwissenschaftliche Geräte im Bereich der Brennstoffzellen eingesetzt werden.
Die Wasserstoffspeicherung kann als Oberflächenadsorption, Porenadsorption oder chemische Aufnahme erfolgen. Für die meisten Metalle ist die Oberflächensorption der vielversprechendste Weg, da sie einfach zu erreichen ist und die Wasserstoffabgabe sehr gut kontrolliert werden kann. Daher werden viele Metalle mit hoher spezifischer Oberfläche untersucht.
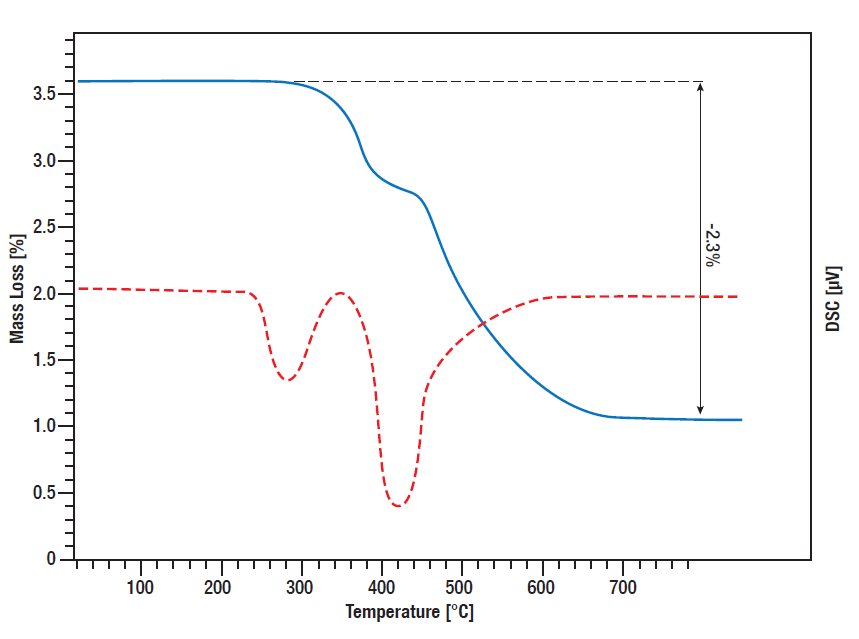
Titanhydrid ist eine häufig genutzte Wasserstoffquelle zur kontrollierten Freisetzung von Wasserstoff in verschiedenen Reaktionen. Zum einen kann es als Katalysator in der Flüssigkeitschemie in situ als Wasserstoffquelle genutzt werden, zum anderen kann es z. B. in Batterien oder Brennstoffzellen zur kontrollierten Wasserstoffabgabe eingesetzt werden.
Um eine Vorstellung davon zu bekommen, welche Menge an Wasserstoff bei welcher Temperatur freigesetzt wird, ist es wichtig, das temperaturabhängige Zersetzungsverhalten und die freigesetzte Wärmemenge zu kennen, was durch eine simultane thermische Analyse (STA) überwacht werden kann.
In dieser STA-Messung wurde die Freisetzung von Wasserstoff durch Titanhydrid überwacht. TG- und DSC-Signal wurden von Raumtemperatur bis 800°C gemessen, während die Probe linear in Argon-Atmosphäre mit 10 K/min aufgeheizt wurde. Zwischen 300°C und 600°C gibt es einen zweistufigen Massenverlust von insgesamt 2,3%, was bedeutet, dass die gesamte Menge des gebundenen Wasserstoffs in diesem Prozess freigesetzt wird. Die DSC-Kurve zeigt die entsprechenden Desorptionspeaks (rote Kurve).
Sicherheit bei Wasserstoffmessungen
Wasserstoff hat eine hohe Affinität zu Oxidationsmitteln und Metalloberflächen sowie zu Sauerstoff. Die Bildung von Wasser aus den Elementen (2 – H2 + O 2 = 2 – H2O; ΔH = 286 kJ/mol) ist eine exotherme Reaktion, weswegen Wasserstoff als leistungsfähiger Energiespeicher gilt.
Wasserstoff-Luft-Gemische sind bei Wasserstoffgehalten größer als ca. 4 % explosionsgefährdet. Die Aktivierungsenergie (ohne Katalysator) ist hoch, aber in Gegenwart einer Flamme, eines Funkens oder hoher Temperatur können solche Gemische brennen oder explodieren. Daher sind bei jeder thermischen Analyse mit Wasserstoffkonzentrationen größer als 4% in Luft einige Sicherheitsvorkehrungen erforderlich.
Alle LINSEIS-Thermoanalysatoren für Wasserstoffanwendungen können mit den folgenden Sicherheitsmerkmalen ausgestattet werden:

- Wasserstoffdetektoren: erkennen eventuelle Leckagen in den Gasleitungen. Diese Detektoren werden in der Nähe des Geräts positioniert und erkennen jede Leckage oder versehentliche Freisetzung von Wasserstoff.
- Spülung mit Inertgas: Wenn eine Leckage erkannt und die Wasserstoffversorgung gestoppt wird, wird der Restwasserstoff im Analysator mit Inertgas ausgespült.
- Sicherheitsventile:
Sobald eine Wasserstoffleckage erkannt wird, werden Sicherheitsventile aktiv und unterbrechen die Wasserstoffzufuhr zum Thermoanalysator.
- Abfalleinheit für Ausgasungen:
Alle Linseis Wasserstoffsysteme sind am Ausgasungsanschluss mit einer Abfackeleinheit ausgestattet. Die Ausgasungen (Messgas, Spülgas und Zersetzungsprodukte) passieren die konstant brennende Flamme, um sicherzustellen, dass keine brennbaren Gase an die Umgebung abgegeben werden und im Labor eine kritische Konzentration erreichen können. Die Flammeneinheit ist elektrisch beheizt und verfügt über einen Sicherheitsmechanismus, der ein Zurückschlagen der Flamme in die Gasleitungen verhindert.
