Table of Contents
Was ist der Unterschied zwischen endothermen und exothermen Reaktionen?
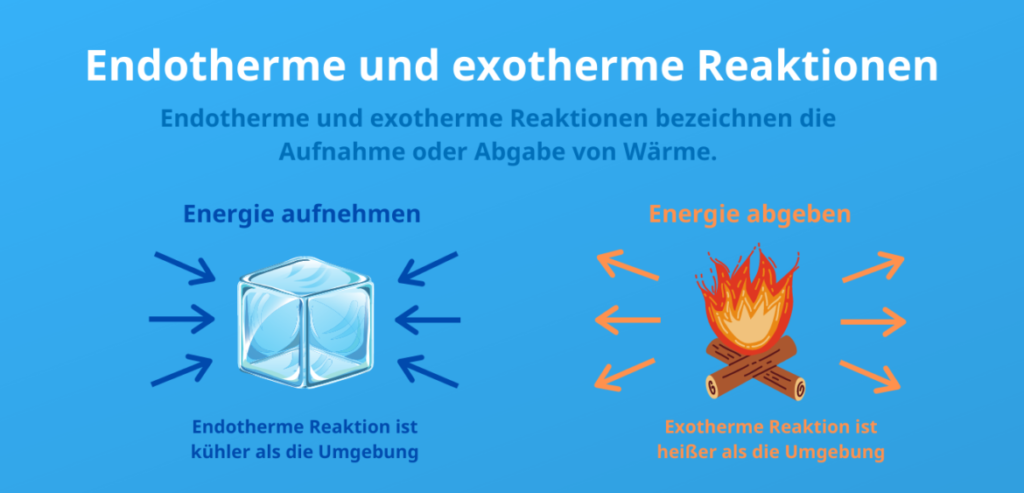
Der Hauptunterschied zwischen exothermen und endothermen Reaktionen liegt im Wärmeaustausch mit der Umgebung:
- Endotherme Reaktionen absorbieren Energie in Form von Wärme aus ihrer Umgebung, was dazu führt, dass die Umgebung kälter wird. Das bedeutet, dass die Produkte mehr Energie haben als die Edukte, und die Reaktion erfordert Wärme, was zu einer positiven Änderung der Enthalpie (ΔH) führt.
- Exotherme Reaktionen geben Energie in Form von Wärme an ihre Umgebung ab, was dazu führt, dass die Umgebung wärmer wird. In diesem Fall haben die Produkte weniger Energie als die Edukte, und die Reaktion gibt Wärme ab, was zu einer negativen Änderung der Enthalpie (ΔH) führt.
Wie identifiziert man eine exotherme bzw. endotherme Reaktion?
Es gibt zwei Methoden, um exotherme Reaktionen zu erkennen:
- Temperaturveränderung;
- Bei einer exothermen Reaktion wird Energie freigesetzt, was dazu führt, dass die Temperatur des Reaktionsgemischs steigt. Im Gegensatz dazu wird bei einer endothermen Reaktion Energie absorbiert, was zu einer Abnahme der Temperatur führt. Sie können Änderungen der Temperatur beobachten, indem Sie ein Thermometer in das Reaktionsgemisch setzen
- Enthalpieänderug:
- Die Enthalpieänderung (ΔH) ist die Differenz zwischen der Energie der Produkte und der Energie der Edukte. Wenn ΔH negativ ist, handelt es sich um eine exotherme chemische Reaktion, weil mehr Energie freigesetzt wird, wenn die Produkte gebildet werden, als Energie verwendet wird, um die Edukte zu zerlegen. Wenn ΔH positiv ist, handelt es sich um eine endotherme chemische Reaktion, weil weniger Energie freigesetzt wird, wenn die Produkte gebildet werden, als die Energie, die verwendet wird, um die Edukte zu zerlegen.
Exotherme und endotherme Reaktionen haben unterschiedliche Auswirkungen auf die Umwelt:
Exotherme Reaktionen geben Wärme an die Umgebung ab, was sowohl positive als auch negative Umweltauswirkungen haben kann. Sie sind beispielsweise an Prozessen wie der Atmung, der Verbrennung und der Energieerzeugung beteiligt. Exotherme Reaktionen können jedoch auch zu Umweltproblemen wie Luft- und Wasserverschmutzung beitragen.
Weitere Beispiele für exotherme Reaktionen:
- Verbrennung von Holz oder Kohle:
- Bei der Verbrennung von Holz oder Kohle wird Wärme freigesetzt, was exotherm ist. Diese Reaktionen werden in Heizungen, Öfen und Motoren zur Energiegewinnung genutzt.
- Oxidation von Metallen:
- Wenn Metalle mit Sauerstoff reagieren, wie zum Beispiel Eisen, um Rost zu bilden, handelt es sich um eine exotherme Reaktion, bei der Wärme freigesetzt wird.
- Chemische Sprengstoffe:
- Explosionen in chemischen Sprengstoffen sind exotherme Reaktionen, bei denen große Mengen an Energie in Form von Hitze und Druck freigesetzt werden.
Endotherme Reaktionen absorbieren Wärme aus der Umgebung. Obwohl sie für Prozesse wie die Photosynthese und das Kochen unerlässlich sind, haben sie im Allgemeinen eine geringere direkte Auswirkung auf die Umwelt im Vergleich zu exothermen Reaktionen.
Weitere Beispiele für endotherme Reaktionen:
- Photosynthese:
- In der Photosynthese nehmen Pflanzen Kohlendioxid aus der Luft auf und wandeln es unter Verwendung von Lichtenergie in Zucker und Sauerstoff um. Dies ist eine endotherme Reaktion, da Energie in Form von Licht aufgenommen wird
- Kochen von Wasser:
- Das Erhitzen von Wasser, um es zum Kochen zu bringen, ist eine endotherme Reaktion. Während des Kochvorgangs wird Energie in Form von Wärme zugeführt, um die Wasserpartikel in Dampf umzuwandeln.
- Lösung von Salz in Wasser:
- Wenn Salz in Wasser gelöst wird, absorbieren die Salzmoleküle Wärme aus der Umgebung, um die Kristalle aufzubrechen und sich in gelöster Form zu verteilen.
