Enthalpie
Enthalpie – eine Messgröße der thermischen Analyse
Was ist die Enthalpie?
Als Reaktionsenthalpie bezeichnet man die Enthalpieänderung einer Probe während einer chemischen Reaktion. Reaktionen, bei denen Energie in Form von Wärme frei wird bezeichnet man dabei als exotherm. Reaktionen, bei denen Energie zugeführt werden muss als endotherm.
Schmelzenthalpien sind dabei ein einfaches Beispiel für endotherme Vorgänge, da man meistens Wärmearbeit in ein System geben muss, um dessen feste Kristallstruktur aufzubrechen und es in eine flüssige Phase mit frei gegeneinander beweglichen Molekülen zu überführen. Ein Beispiel für eine exotherme Reaktion ist ein einfacher Verbrennungsvorgang, bei dem ein Stoff unter Abgabe von Energie mit Sauerstoff reagiert.
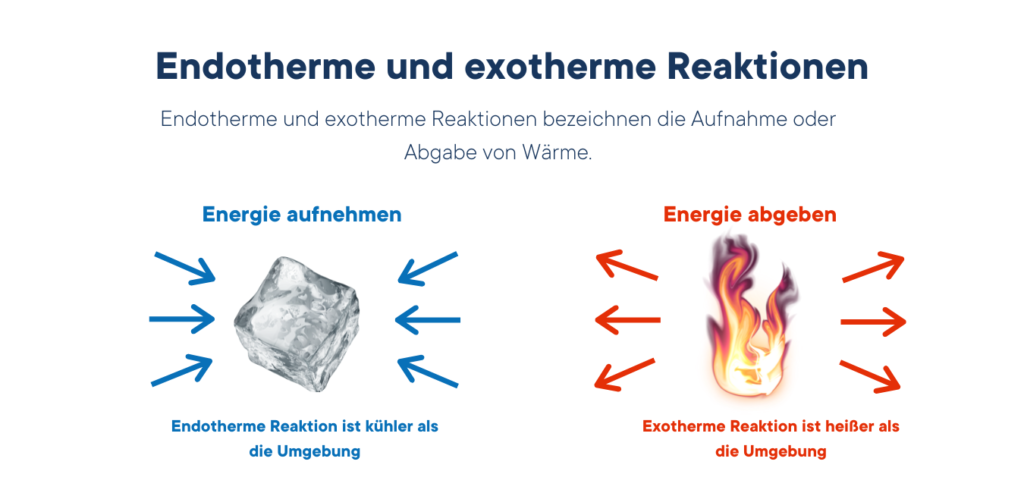
Der Unterschied zwischen endothermer und exothermer Reaktion:
Endotherm:
- Energie wird verbraucht (Wärme wird absorbiert)
- Energie für die Reaktion verbraucht oder benötigt wird
- Zunahme der inneren Enthalphie
Beispiele für endotherme Prozesse sind:
- Lösen von Salzen in Lösungsmittel
- Spaltung von Alkanen
- Verdampfende Flüssigkeiten
- Schmelzende Feststoffe
Exotherm:
- Energie wird freigesetzt (Wärme wird freigesetzt)
- Reaktion erfolgt spontan oder ausgelöst
- Abnahme der inneren Enthalphie
Beispiele für exotherme Prozesse:
- Die Thermit-Reaktion
- Eine Neutralisierung (z.B. das Mischen einer Säure und einer Base zur Bildung eines Salzes und von Wasser)
- Die meisten Polymerisationsreaktionen
- Verbrennung
- Respiration
- Korrosion von Metallen (eine Oxidationsreaktion)
- Die meisten Kristallisationsprozesse

